As suas observações 1, 2, 3 e 5 estão corretas. Na 4 apenas acrescentaria que se forma um sal o
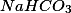
que está totalmente dissociado em água, gerando os íons
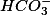
e
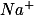
, o qual não precisamos escrever pois não participa do equilíbrio.
A alternativa B está errada, pois ao adicionarmos mais NaOH, os íons
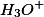
são consumidos para formação de água. Com a diminuição desses íons, o sistema tenta restabelecer a sua concentração, produzindo mais
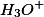
, e o equilíbrio se desloca para a direita, e nisso também acaba produzindo mais íons
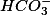
, aumentando a sua coocentração.
Espero ter ajudado!






