Química Geral ⇒ Reacção Redox
Moderador: [ Moderadores TTB ]
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Abr 2016
13
12:42
Reacção Redox
Acerte a seguinte equação Redox usando as regras por si conhecidas:
_{3}+MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Editado pela última vez por Cientista em 13 Abr 2016, 12:42, em um total de 1 vez.
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Abr 2016
14
08:14
Re: Reacção Redox
É difícil, ou pelo menos eu não sei como fazer para clocar os estados de oxidação de cada elemento usando o látex, por isso tentemos desse modo:
No , o estado de oxidação do ferro é
, o estado de oxidação do ferro é  , já que íon sulfato tem carga
, já que íon sulfato tem carga 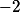 .
.
No_3) , o estado de oxidação do ferro é
, o estado de oxidação do ferro é  , pelo mesmo motivo acima.
, pelo mesmo motivo acima.
Logo, o íon ferro oxidou, pois perdeu elétrons.
A varição de seu número de oxidação foi:\right| \times 2=2)
No , o estado de oxidação do manganês é
, o estado de oxidação do manganês é  , já que íon óxido é
, já que íon óxido é 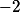 e o íon potássio é
e o íon potássio é  .
.
No , o estado de oxidação do manganês é
, o estado de oxidação do manganês é  , já que íon sulfato tem carga
, já que íon sulfato tem carga 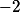 .
.
Logo, o íon manganês reduziu, pois ganhou elétrons.
A varição de seu número de oxidação foi:\right| =5)
_{3}+MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Vamos iniciar o acerto dos coeficientes pelo segundo membro:
Coloquemos 5 no_{3}) e 2 no
e 2 no 
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Note que há 10 átomos de ferro no segundo membro e, por isso, temos que colocar 10 no para acertarmos o ferro no primeiro membro.
para acertarmos o ferro no primeiro membro.
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Procuremos sempre acertar o menos comum de maior índice. Como há 2 potássios no segundo membro, coloquemos 2 no :
:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Por hora, o hidrogênio já está certo.
Note que há 11 enxofres no primeiro membro e 18 enxofres no segundo membro. para acerta esse elemento, coloquemos 8 no :
:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Agora desbalanceamos o hidrogênio, então coloquemos 8 na água:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+8 \ H_{2}O)
A equação já está balanceada, note ainda que há 80 oxigênios em cada membro.
Espero ter ajudado!
No
No
Logo, o íon ferro oxidou, pois perdeu elétrons.
A varição de seu número de oxidação foi:
No
No
Logo, o íon manganês reduziu, pois ganhou elétrons.
A varição de seu número de oxidação foi:
Vamos iniciar o acerto dos coeficientes pelo segundo membro:
Coloquemos 5 no
Note que há 10 átomos de ferro no segundo membro e, por isso, temos que colocar 10 no
Procuremos sempre acertar o menos comum de maior índice. Como há 2 potássios no segundo membro, coloquemos 2 no
Por hora, o hidrogênio já está certo.
Note que há 11 enxofres no primeiro membro e 18 enxofres no segundo membro. para acerta esse elemento, coloquemos 8 no
Agora desbalanceamos o hidrogênio, então coloquemos 8 na água:
A equação já está balanceada, note ainda que há 80 oxigênios em cada membro.
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 14 Abr 2016, 08:14, em um total de 1 vez.
So many problems, so little time!
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Abr 2016
18
22:26
Re: Reacção Redox
Eu tentei com a reac;cão FeS + HNO3-> Fe2S3O12+NO+H2O
Mais não consegui, obtive Ferrooo: |+2-(+15)|.2=26 e Nitrogenio |+5-(+2)|.1=3 depois basta trocar, mas não deu certo, não sei onde falhei, mas já entendi o processo de acerto.
Mais não consegui, obtive Ferrooo: |+2-(+15)|.2=26 e Nitrogenio |+5-(+2)|.1=3 depois basta trocar, mas não deu certo, não sei onde falhei, mas já entendi o processo de acerto.
Força e bons estudos!
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Mai 2016
09
20:23
Re: Reacção Redox
Mestre, Ferro tem nox +10 em FeSO4 e o mangans é +7 em KMnO4 e +10 em MnSO4
+10;-2;-2(FeSO4) + +1;+7;-2(KMnO4)+ +1;+6;-2(H2SO4) -> +15;-2;-2(Fe2S3O12 ou Fe(SO4)3 ) + +10;-2;-2(MnSO4) + +1;+6;-2(K2SO4) + +1;-2(H2O)
Se formos a fazer, tudo vai dar zero, não como o Mestre determinou os Noxs, a partir daqui relacionei:
FeSO4-> Fe2S3O12 -> Delta Ferro= | 10-(+15)|.2=10;
FeSO4->K2SO4-> Delta Enxofre=| -2-(+6)|.1=8;
KMnSO4-> MnSO4-> Delta Manganes= |7-(+10)|.1=3;
H2SO4-> MnSO4-> Delta Enxofre=|6-(-2)|.1=8
Foi como eu fiz a determinação dos Noxs, e achar as variações. não sei onde errei Mestre,
+10;-2;-2(FeSO4) + +1;+7;-2(KMnO4)+ +1;+6;-2(H2SO4) -> +15;-2;-2(Fe2S3O12 ou Fe(SO4)3 ) + +10;-2;-2(MnSO4) + +1;+6;-2(K2SO4) + +1;-2(H2O)
Se formos a fazer, tudo vai dar zero, não como o Mestre determinou os Noxs, a partir daqui relacionei:
FeSO4-> Fe2S3O12 -> Delta Ferro= | 10-(+15)|.2=10;
FeSO4->K2SO4-> Delta Enxofre=| -2-(+6)|.1=8;
KMnSO4-> MnSO4-> Delta Manganes= |7-(+10)|.1=3;
H2SO4-> MnSO4-> Delta Enxofre=|6-(-2)|.1=8
Foi como eu fiz a determinação dos Noxs, e achar as variações. não sei onde errei Mestre,
Força e bons estudos!
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Mai 2016
10
07:33
Re: Reacção Redox
Veja:

Note que o oxigênio tem nox = -2, sempre que o oxigênio for um óxido ele tem esse estado.
Note ainda que o íon sulfato tem carga -2: .
.
Portanto, para haver equilíbrio de cargas o ferro tem carga +2.
Daí para o enxofre:=0 \Longleftrightarrow nox_S=+6)
_3) :
:
Mesma que acima.
O íon sulfato tem carga -2, como há três desses íons a carga total negativa é -6. Logo a carga total positiva é +6, como há 2 átomos de ferro, o número de oxidação de cada átomos de ferro é +3.
Note que o oxigênio tem nox = -2, sempre que o oxigênio for um óxido ele tem esse estado.
Note ainda que o íon sulfato tem carga -2:
Portanto, para haver equilíbrio de cargas o ferro tem carga +2.
Daí para o enxofre:
Mesma que acima.
O íon sulfato tem carga -2, como há três desses íons a carga total negativa é -6. Logo a carga total positiva é +6, como há 2 átomos de ferro, o número de oxidação de cada átomos de ferro é +3.
Editado pela última vez por VALDECIRTOZZI em 10 Mai 2016, 07:33, em um total de 1 vez.
So many problems, so little time!
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Mai 2016
10
07:37
Re: Reacção Redox
Tente agora acertar os coeficiente. Deve ficar assim:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+8 \ H_{2}O)
Editado pela última vez por VALDECIRTOZZI em 10 Mai 2016, 07:37, em um total de 1 vez.
So many problems, so little time!
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Mai 2016
10
16:59
Re: Reacção Redox
Percebi Mesre! Em casos, em que na propria reacção eles já põe os noxs dos elemenos, eu considero como 0 ou uso os noxs dados?
Ex:. x^-2 + y-> x+z^-3 eu assumo direco que o nox é de x é -2, uma vez que ele não esá acompahado com ninguém era muio normal eu pôr 0 podendo esar muio errado, quero saber se o nox que o enunciado fornece nos deixamos de lado e consideramos 0 por que ele esá sozinho ou consideramos o nox já dado?
podendo esar muio errado, quero saber se o nox que o enunciado fornece nos deixamos de lado e consideramos 0 por que ele esá sozinho ou consideramos o nox já dado?
Ex:. x^-2 + y-> x+z^-3 eu assumo direco que o nox é de x é -2, uma vez que ele não esá acompahado com ninguém era muio normal eu pôr 0
Força e bons estudos!
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Mai 2016
11
08:50
Re: Reacção Redox
Eu não sei se entendi a dúvida, mas se temos um íon:
 , o
, o 
 , o
, o 
 , o
, o 
 , temos:
, temos:
=-3)

Editado pela última vez por VALDECIRTOZZI em 11 Mai 2016, 08:50, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 3 Respostas
- 890 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 733 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 833 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 999 Exibições
-
Última mensagem por muriloflo
-
- 1 Respostas
- 2456 Exibições
-
Última mensagem por VALDECIRTOZZI
