Um suco de tomate tem pH=4 e um suco de limão tem pH=2. Calcule o volume de solução aquosa de NaOH de concentração 0,010mol/L necessário para neutralizar 100mL de cada um dos sucos.
Para que o ácido seja neutralizado, deve ocorrer uma titulação ácido-base. Portanto:
[tex3]n_a_c__i_d_o=n_b_a_s_e[/tex3]
[tex3]M_a_c__i_d_oV_a_c__i_d_o=M_b_a_s_eV_b_a_s_e[/tex3]
[tex3]V_b_a_s_e=10M_a_c__i_d_o[/tex3]
Estaria certo se eu fizesse assim e dissesse que estaria ocorrendo uma titulação?
Físico-Química ⇒ (UNESP) Equilíbrio Ácido-Base Tópico resolvido
Moderador: [ Moderadores TTB ]
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Mai 2015
12
08:39
Re: (UNESP) Equilíbrio Ácido-Base
A) Tomate:

É necessário de
de 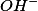 para neutralização.
para neutralização.



n) Limão:

É necessário de
de 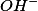 para neutralização.
para neutralização.



O volume total de solução de base é
Espero ter ajudado!
É necessário
n) Limão:
É necessário
O volume total de solução de base é
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 12 Mai 2015, 08:39, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 0 Respostas
- 901 Exibições
-
Última mensagem por Ósmio
-
- 1 Respostas
- 676 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 4 Respostas
- 4328 Exibições
-
Última mensagem por GabrielaC
-
- 2 Respostas
- 839 Exibições
-
Última mensagem por guilhermeP
-
- 3 Respostas
- 1318 Exibições
-
Última mensagem por marcosdrey

