O hidróxido de sódio, produzido em laboratório por meio da reação de hidratação do óxido de sódio, pode ser empregado na titulação (determinação da concentração) de soluções ácidas.
A massa, em gramas, de óxido de sódio contendo 20% de impurezas inertes que, dissolvida em água, produz a quantidade em mols de hidróxido de sódio necessária para neutralizar completamente 200mL de uma solução aquosa de ácido sulfúrico de concentração igual a 0,5 mol.[tex3]L^{-1}[/tex3]
é de
A)3,10
B)6,20
C)7,75
D)8,00
E)10,00
Química Geral ⇒ (UNIFESO-RJ) Soluções
Moderador: [ Moderadores TTB ]
- gabrielxpg

- Mensagens: 14
- Registrado em: 14 Jun 2014, 02:08
- Última visita: 16-06-14
- Agradeceu: 3 vezes
Jun 2014
14
19:10
(UNIFESO-RJ) Soluções
Editado pela última vez por gabrielxpg em 14 Jun 2014, 19:10, em um total de 1 vez.
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Jun 2014
16
10:16
Re: (UNIFESO-RJ) Soluções
Escrevamos incialmente a reação de neutralização entre o ácido sulfúrico e hidróxido de sódio:

A quantidade em mols de neutralizada foi de:
neutralizada foi de:
}=0,5 \times 0,200=0,1) mol.
mol.
A estequeometria da reação nos diz que 1 mol d eácido é neutralizado por 2 mols de base, então precisarei de 0,2 mols de NaOH para neutralizar o ácido.
Agora a reação para a obtenção da base a partir do óxido de sódio:

Por essa reação observamos que 1 mol de fornecem 2 mols de
fornecem 2 mols de  , como obtive 0,2 mols da base, precisarei de 0,1 mol de
, como obtive 0,2 mols da base, precisarei de 0,1 mol de  .
.
A massa molar) do
do  é:
é:  , e sabemos que o número de mols
, e sabemos que o número de mols ) é dado pela relação
é dado pela relação 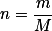 , onde
, onde 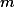 é a massa, em gramas, da substância:
é a massa, em gramas, da substância:
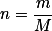

 de
de  .
.
Contudo, essa massa correspinde a apenas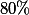 do áxido já que ele tem
do áxido já que ele tem 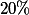 de impurezas, para podemos obtê-la a partir do sal impuro devemos ter:
de impurezas, para podemos obtê-la a partir do sal impuro devemos ter: .
.
Espero ter ajudado!
A quantidade em mols de
A estequeometria da reação nos diz que 1 mol d eácido é neutralizado por 2 mols de base, então precisarei de 0,2 mols de NaOH para neutralizar o ácido.
Agora a reação para a obtenção da base a partir do óxido de sódio:
Por essa reação observamos que 1 mol de
A massa molar
Contudo, essa massa correspinde a apenas
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 16 Jun 2014, 10:16, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 2 Respostas
- 1567 Exibições
-
Última mensagem por Gabibt
-
- 2 Respostas
- 1297 Exibições
-
Última mensagem por gabrielxpg
-
- 1 Respostas
- 707 Exibições
-
Última mensagem por PedroCunha
-
- 1 Respostas
- 1106 Exibições
-
Última mensagem por aleixoreis
-
- 1 Respostas
- 709 Exibições
-
Última mensagem por PedroCunha
