O ar atmosférico contém aproximadamente 78% de N2
e 21% de O2 , em volume. Sua composição química e
percentual pode modificar-se de acordo com o local e outras
variáveis como produção de poluentes gasosos, entretanto
essas proporções de nitrogênio e oxigênio, geralmente,
oscilam em torno dos valores percentuais citados.
Considerando 100 L de uma mistura gasosa, com a mesma
composição do ar atmosférico descrito, e densidade igual a
1,2 Kg/m3 (0,0012 g/cm3) a 20º C, pode-se afirmar que:
A) o volume de 100 L da mistura gasosa é suficiente
para a queima total de 200 g de CH4 (s), considerando a combustão completa do combustível.
B) em 100 L da mistura gasosa está contida uma
quantidade de matéria de oxigênio maior que 1 mol.
C) a combustão completa de 200 g de metano consome
um volume aproximado de 560 L de oxigênio.
D) a pressão parcial exercida pelo nitrogênio na mistura
gasosa é menor que a pressão parcial do oxigênio.
E) a massa de oxigênio contida em 100 L da mistura
gasosa é maior que a massa de oxigênio necessária
para a queima completa de 200 g de metano.
Gab c
Se possível, item por item
obrigada desde já!
Química Geral ⇒ (IFBA-2013) Gases
Moderador: [ Moderadores TTB ]
-
doraoliveira

- Mensagens: 217
- Registrado em: 06 Jan 2016, 01:11
- Última visita: 30-11-18
- Agradeceu: 32 vezes
- Agradeceram: 5 vezes
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2016
18
08:18
Re: (IFBA-2013) Gases
a) A equação química que representa a combustão do metano é:
}+2O_2 \longrightarrow CO_2_{(g)}+2H_2O_{(v)})
Temos que 1 mol de reagem com 2 mols de gás oxigênio.
reagem com 2 mols de gás oxigênio.

Serão, portanto necessários 25 mols de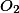 , ou
, ou 
Em 100 litros da mistura gasosa há 21% em volume de gás oxigênio ou 21 litros.

A massa de gás oxigênio em 100 litros de mistura é insuficiente.
b)
c) Vimos que a massa de gás oxigênio necessária para a combustão são 800 g.
Logo:

d) Como o volume de gás nitrogênio é maior, há mais moléculas dele na mistura. logo sua pressão é maior.
e) Pelos cálculos acima está opção está errada.
Temos que 1 mol de
Serão, portanto necessários 25 mols de
Em 100 litros da mistura gasosa há 21% em volume de gás oxigênio ou 21 litros.
A massa de gás oxigênio em 100 litros de mistura é insuficiente.
b)
c) Vimos que a massa de gás oxigênio necessária para a combustão são 800 g.
Logo:
d) Como o volume de gás nitrogênio é maior, há mais moléculas dele na mistura. logo sua pressão é maior.
e) Pelos cálculos acima está opção está errada.
Editado pela última vez por VALDECIRTOZZI em 18 Nov 2016, 08:18, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 1 Respostas
- 1030 Exibições
-
Última mensagem por Vinisth
-
- 1 Respostas
- 833 Exibições
-
Última mensagem por Cardoso1979
-
- 1 Respostas
- 1912 Exibições
-
Última mensagem por csmarcelo
-
- 1 Respostas
- 1690 Exibições
-
Última mensagem por petras
-
- 1 Respostas
- 675 Exibições
-
Última mensagem por rcompany
