FMJ 2016 - Considere o esquema de um sistema utilizado para demonstrar a condutividade elétrica de soluções e a tabela que apresenta três soluções aquosas, de mesma concentração, testadas nesse sistema.
O circuito elétrico desse sistema se fecha quando os eletrodos são imersos numa solução contendo íons livres, um material condutor. A lâmpada brilha com intensidade proporcional à passagem de corrente elétrica e à concentração de íons livres na solução.
a) A lâmpada apresentou menor intensidade luminosa quando qual solução foi testada? Justifique sua resposta.
b) O equilíbrio químico envolvido na ionização do composto presente na solução de número 2 pode ser representado pela equação:
[tex3]CH_{3}COOH_{(aq)} = H^{+} _{(aq)} + CH_{3}COO^{-}_{(aq)}[/tex3]
Considerando que uma amostra desse ácido foi diluída com água até se obter uma solução com concentração de íons [tex3]H^{+}[/tex3]
igual a [tex3]10^{-4}[/tex3]
mol [tex3]\cdot[/tex3]
[tex3]L^{-1}[/tex3]
a 25 ºC, determine o valor da concentração, em mol [tex3]\cdot[/tex3]
[tex3]L^{-1}[/tex3]
, do ânion e do ácido nessa solução. Apresente os cálculos efetuados.
Físico-Química ⇒ Condução elétrica em soluções
Moderador: [ Moderadores TTB ]
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2016
23
08:00
Re: Condução elétrica em soluções
a) Como dito no enunciado da questão, a condutividade elétrica é proporcional à concentração de íons livres (já que a concentração inicial de cada ácido é a mesma). Como a constante de ionização do ácido 1 é maior, ele se ioniza em maior extensão, liberando uma quantidade maior de cátions 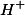 e ânions
e ânions  .
.
b) Se a concentração final de íons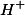 é
é  , esta também será a concentração do ânion
, esta também será a concentração do ânion  , ja que cada mol de ácido libera., em solução aquosa 1 mol de cátion e de ânion.
, ja que cada mol de ácido libera., em solução aquosa 1 mol de cátion e de ânion.
Pela expressão da constante de equilíbrio:
![k_a=\frac{\left[H^+\right]\cdot \left[CH_3COO^-\right]}{\left[CH_3COOH\right]} k_a=\frac{\left[H^+\right]\cdot \left[CH_3COO^-\right]}{\left[CH_3COOH\right]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?k_a=\frac{\left[H^+\right]\cdot \left[CH_3COO^-\right]}{\left[CH_3COOH\right]})
![1,8 \times 10^{-5}=\frac{10^{-4} \cdot 10^{-4}}{\left[CH_3COOH\right]} 1,8 \times 10^{-5}=\frac{10^{-4} \cdot 10^{-4}}{\left[CH_3COOH\right]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?1,8 \times 10^{-5}=\frac{10^{-4} \cdot 10^{-4}}{\left[CH_3COOH\right]})
![\left[CH_3COOH\right]=\frac{10^{-8}}{1,8 \times 10^{-5}}=5,55 \times 10^ {-4} \ mol/\ell \left[CH_3COOH\right]=\frac{10^{-8}}{1,8 \times 10^{-5}}=5,55 \times 10^ {-4} \ mol/\ell](https://www.tutorbrasil.com.br/latex/mathtex.cgi?\left[CH_3COOH\right]=\frac{10^{-8}}{1,8 \times 10^{-5}}=5,55 \times 10^ {-4} \ mol/\ell)
Espero ter ajudado!
b) Se a concentração final de íons
Pela expressão da constante de equilíbrio:
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 23 Nov 2016, 08:00, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 2 Respostas
- 1602 Exibições
-
Última mensagem por dinah
-
- 3 Respostas
- 455 Exibições
-
Última mensagem por dinah
-
- 0 Respostas
- 965 Exibições
-
Última mensagem por APSmed
-
- 1 Respostas
- 2469 Exibições
-
Última mensagem por lfernando
-
- 0 Respostas
- 1082 Exibições
-
Última mensagem por ViniMartins

