A questão é do livro Usberco e Salvador e apresenta duas soluções:
1 - A primeira solução contém: 0,2 mol de H+ e 0,1 mol de [tex3]SO_4^2-[/tex3]
em 0,1 L de solução.
2 - A segunda solução contém 0,1 mol de Na+ e 0,1 mol de OH- em 0,4 L de solução.
- Mistura-se essas soluções e obtém-se uma solução final com 0,5 L.
Pergunta-se: Qual é o número de mol de [tex3]H_2SO_4[/tex3]
presente na solução final?
A resposta é : 0,05 mol.
Minha dúvida é: Como o nº de mol é 0,05? Não consigo entender.
Físico-Química ⇒ Mistura de soluções com reação química
- dudasaraiva

- Mensagens: 2
- Registrado em: 14 Dez 2015, 20:42
- Última visita: 15-12-15
- Agradeceu: 1 vez
- Agradeceram: 1 vez
Dez 2015
15
00:10
Mistura de soluções com reação química
Editado pela última vez por dudasaraiva em 15 Dez 2015, 00:10, em um total de 1 vez.
- emanuel9393

- Mensagens: 2658
- Registrado em: 28 Dez 2011, 20:39
- Última visita: 28-03-24
- Localização: Petrolina - PE
- Agradeceu: 623 vezes
- Agradeceram: 1043 vezes
Dez 2015
15
03:08
Re: Mistura de soluções com reação química
Olá, Dudasaraiva!
Trata-se de uma reação de neutralização entre o ácido forte ( ) e uma base forte
) e uma base forte ) . Temos que os
. Temos que os  de
de 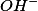 irá se combinar integralmente com
irá se combinar integralmente com  de
de 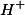 formando
formando  de
de 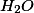 . Com isso, resta somente
. Com isso, resta somente  de
de 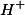 . Esboçando a equação estequiométrica de formação de ácido sulfúrico:
. Esboçando a equação estequiométrica de formação de ácido sulfúrico:
 Ou seja, existe uma proporção estequiométrica de
Ou seja, existe uma proporção estequiométrica de  de
de 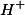 para
para  de
de  . Logo, se tínhamos
. Logo, se tínhamos  de
de 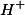 , teremos
, teremos  de
de  .
.
Espero ter ajudado!
Grande abraço!
Trata-se de uma reação de neutralização entre o ácido forte (
Espero ter ajudado!
Grande abraço!
Editado pela última vez por emanuel9393 em 15 Dez 2015, 03:08, em um total de 1 vez.
As modernas teorias científica afirmam que em dentro de 5 bilhões de anos, a humanidade presenciará a morte do sol. Imagine como seria presenciar esse evento...
- dudasaraiva

- Mensagens: 2
- Registrado em: 14 Dez 2015, 20:42
- Última visita: 15-12-15
- Agradeceu: 1 vez
- Agradeceram: 1 vez
Dez 2015
15
11:47
Re: Mistura de soluções com reação química
Valeuu. Ajudou muito!emanuel9393 escreveu:Olá, Dudasaraiva!
Trata-se de uma reação de neutralização entre o ácido forte () e uma base forte
. Temos que os
de
irá se combinar integralmente com
de
formando
de
. Com isso, resta somente
de
. Esboçando a equação estequiométrica de formação de ácido sulfúrico:
Ou seja, existe uma proporção estequiométrica dede
para
de
. Logo, se tínhamos
de
, teremos
de
.
Espero ter ajudado!
Grande abraço!
Abraço!
Editado pela última vez por dudasaraiva em 15 Dez 2015, 11:47, em um total de 1 vez.
-
- Tópicos Semelhantes
- Resp.
- Exibições
- Últ. msg
-
- 1 Resp.
- 3816 Exibições
-
Últ. msg por Jigsaw
-
- 1 Resp.
- 2584 Exibições
-
Últ. msg por leomaxwell
-
- 1 Resp.
- 1671 Exibições
-
Últ. msg por aluno20000
-
- 2 Resp.
- 11682 Exibições
-
Últ. msg por Nathaly
-
- 1 Resp.
- 1212 Exibições
-
Últ. msg por Jigsaw
