É difícil, ou pelo menos eu não sei como fazer para clocar os estados de oxidação de cada elemento usando o látex, por isso tentemos desse modo:
No

, o estado de oxidação do ferro é

, já que íon sulfato tem carga
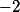
.
No
_3)
, o estado de oxidação do ferro é

, pelo mesmo motivo acima.
Logo, o íon ferro oxidou, pois perdeu elétrons.
A varição de seu número de oxidação foi:
\right| \times 2=2)
No

, o estado de oxidação do manganês é

, já que íon óxido é
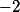
e o íon potássio é

.
No

, o estado de oxidação do manganês é

, já que íon sulfato tem carga
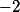
.
Logo, o íon manganês reduziu, pois ganhou elétrons.
A varição de seu número de oxidação foi:
\right| =5)
_{3}+MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Vamos iniciar o acerto dos coeficientes pelo segundo membro:
Coloquemos 5 no
_{3})
e 2 no

_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Note que há 10 átomos de ferro no segundo membro e, por isso, temos que colocar 10 no

para acertarmos o ferro no primeiro membro.
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Procuremos sempre acertar o menos comum de maior índice. Como há 2 potássios no segundo membro, coloquemos 2 no

:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Por hora, o hidrogênio já está certo.
Note que há 11 enxofres no primeiro membro e 18 enxofres no segundo membro. para acerta esse elemento, coloquemos 8 no

:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+H_{2}O)
Agora desbalanceamos o hidrogênio, então coloquemos 8 na água:
_{3}+2 \ MnSO_{4}+K_{2}SO_{4}+8 \ H_{2}O)
A equação já está balanceada, note ainda que há 80 oxigênios em cada membro.
Espero ter ajudado!
_{3}+MnSO_{4}+K_{2}SO_{4}+H_{2}O)