(UFV) Equilíbrio Químico
Enviado: 24 Ago 2014, 13:44
O crômio, com número de oxidação igual a +6, forma espécies com algumas propriedades diferentes como o cromato,  , e o dicromato,
, e o dicromato, 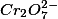 . Essas espécies, em solução aquosa, estão em equilíbrio, podendo o equilíbrio ser modificado acidificando ou basificando o meio.
. Essas espécies, em solução aquosa, estão em equilíbrio, podendo o equilíbrio ser modificado acidificando ou basificando o meio.
} + H_2O_{(l)} \rightleftharpoons 2 CrO_4^{2-}_{(aq)} + 2H^+_{(aq)})
A solução de dicromato é alaranjada e o seu sal de bário é solúvel em água. A solução de cromato é amarelada e o seu sal de bário é pouco solúvel em água.
Se numa solução de dicromato de bário for adicionado ácido ou base modificando seu pH, é possível prever que:
a) adicionando HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário formará um compostou pouco solúvel
b) adicionado NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário formará um composto pouco solúvel
c) adicionado NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário permanecerá solúvel
d) adicionado HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário permanecerá solúvel
Gab.: B
A solução de dicromato é alaranjada e o seu sal de bário é solúvel em água. A solução de cromato é amarelada e o seu sal de bário é pouco solúvel em água.
Se numa solução de dicromato de bário for adicionado ácido ou base modificando seu pH, é possível prever que:
a) adicionando HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário formará um compostou pouco solúvel
b) adicionado NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário formará um composto pouco solúvel
c) adicionado NaOH, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon dicromato, que na presença do íon bário permanecerá solúvel
d) adicionado HCl, o equilíbrio entre as duas espécies será deslocado no sentido de formação do íon cromato, que na presença do íon bário permanecerá solúvel
Resposta
Gab.: B