Página 1 de 1
(Petrobras-2013) Equilíbrio
Enviado: 13 Mai 2014, 16:58
por priscilasp
Ácido carbônico é um eletrólito muito fraco que, em meio aquoso e em concentração 0,1 mol/L, apresenta o seguinte equilíbrio:

Se, a 200 mL dessa solução são adicionados aproximadamente 2 mL de solução aquosa de

, 0,1 mol/L, ocorre a(o)
(A) manutenção do equilíbrio do meio, pois não há íons
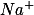
e
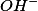
na equação.
(B) diminuição da concentração de

até o restabelecimento de novo equilíbrio.
(C) forte união do
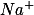
do

ao
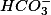
formando composto sólido.
(D) aumento da concentração de

até o restabelecimento de novo equilíbrio.
(E) consumo de

e o aumento do pH do meio.
Re: (Petrobras-2013) Equilíbrio
Enviado: 16 Mai 2014, 10:26
por VALDECIRTOZZI
Considerando o equilíbrio:

Com a adição de íons
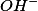
, temos o consumo de íons
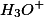
, formando água.
Como há retirada de
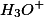
do equilíbrio, este, pelo Princípio de Le Chatelier, desloca-se para a direita, produzindo tentando restabelecer o equilíbrio. Vom isso há formação de mais íons
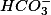
e aumento do pH do meio.
Resposta E.
Espero ter ajudado!
Re: (Petrobras-2013) Equilíbrio
Enviado: 16 Mai 2014, 18:57
por priscilasp
vlw ajudou bastante
Re: (Petrobras-2013) Equilíbrio
Enviado: 02 Dez 2014, 13:40
por FelipeRB
Eu fiquei com um pouco de dúvida nessa questão, tenho uma certa dificuldade com equilíbrio quando aborda características mais avançadas um pouco. Alguém poderia me ajudar?

Imagino que a reação seja assim:
1) Adiciona-se o ácido na água, que se ioniza parcialmente com um rendimento X (ou seja, sobram moléculas sem ionizar e as que ionizam cedem apenas um H+ como mostra a reação).
2) Adiciona-se NaOH na água, que se dissocia liberando Na+ e OH-.
3) As moléculas de OH- se juntarão com as de H3O- do ácido formando 2H2O.
4) As moléculas de Na+ se juntarão com as de HCO3- do ácido e formarão o sal, porém será uma união fraca.
5) Acontece então uma suposta neutralização do meio, o que desequilibra a reação no sentido direto, incentivando a produção de mais íons até que o equilíbrio seja restabelecido.
É isso mesmo ou cometi algum engano?!
Eu presumo que as outras alternativas estão erradas pois:
A)
Existem sim os íons Na+ e OH- que causam desiquilíbrio.
C)
A união é fraca, visto que o ácido carbônico é um ácido fraco e que não se ioniza completamente.
D)
Diminuição de H2CO3 visto que seus íons foram neutralizados e foi necessário mais consumo do ácido para atingir novamente o equilíbrio.
Por que é que a alternativa
B está errada?
Re: (Petrobras-2013) Equilíbrio
Enviado: 03 Dez 2014, 08:29
por VALDECIRTOZZI
As suas observações 1, 2, 3 e 5 estão corretas. Na 4 apenas acrescentaria que se forma um sal o
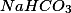
que está totalmente dissociado em água, gerando os íons
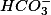
e
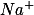
, o qual não precisamos escrever pois não participa do equilíbrio.
A alternativa B está errada, pois ao adicionarmos mais NaOH, os íons
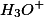
são consumidos para formação de água. Com a diminuição desses íons, o sistema tenta restabelecer a sua concentração, produzindo mais
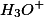
, e o equilíbrio se desloca para a direita, e nisso também acaba produzindo mais íons
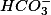
, aumentando a sua coocentração.
Espero ter ajudado!
Re: (Petrobras-2013) Equilíbrio
Enviado: 03 Dez 2014, 16:02
por FelipeRB
Valdecir, com certeza você ajudou! Finalmente encontrei uma resposta digna de elogio, que esclareceu minha dúvida

+1!
Re: (Petrobras-2013) Equilíbrio
Enviado: 08 Dez 2015, 14:49
por DoctorWell
Pessoal,
Desculpem-me pela ignorância, não sei se deveria perguntar aqui ou criar um novo tópico. Optei por aqui mesmo, porque a dúvida relaciona-se com o enunciado desta questão.
Sei que, por ser um ácido fraco, o ácido carbônico decompõe-se em H2O e CO2. Mas, às vezes, ele ioniza-se em H3O+ e HCO3-. Quando acontece um e quando acontece outro?
Seria: em meio aquoso ele ioniza-se e, quando formado no produto de reações quím., ele se decompõe?
Perdão mais uma vez, rs, mas se alguém puder me ajudar, ficarei muito grato.
Abs
Re: (Petrobras-2013) Equilíbrio
Enviado: 09 Dez 2015, 07:25
por VALDECIRTOZZI
Eu poderia dizer-lhe que sua colocação está correta, o ácido carbônico, em solução aquosa, ioniza-se em íons [tex3]H^+[/tex3]
ou, se preferir em
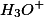
e íons bicarbonato, caso contrário, ele se decompõe em gás carbônico e água.
Claro que para saber exatamente o que ocorre é necessário examinar o sistema em que a reação está ocorrendo.
Espero ter ajudado!
Re: (Petrobras-2013) Equilíbrio
Enviado: 09 Dez 2015, 08:10
por DoctorWell
Muito obrigado, Valdecir!
+1!
Abs

 , 0,1 mol/L, ocorre a(o)
, 0,1 mol/L, ocorre a(o)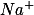 e
e 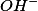 na equação.
na equação. até o restabelecimento de novo equilíbrio.
até o restabelecimento de novo equilíbrio.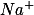 do
do  ao
ao 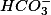 formando composto sólido.
formando composto sólido. até o restabelecimento de novo equilíbrio.
até o restabelecimento de novo equilíbrio. e o aumento do pH do meio.
e o aumento do pH do meio.