A equação geral dos gases ideais é uma equação de estado que correlaciona pressão, temperatura, volume e quantidade de matéria, sendo uma boa aproximação ao comportamento da maioria dos gases.
Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e variação de dois parâmetros. Numere as representações gráficas relacionando-as com as seguintes descrições.
1. Ao encher um balão com gás hélio ou oxigênio, o balão apresentará a mesma dimensão.
2. Ao encher um pneu de bicicleta, é necessária uma pressão maior que a utilizada em pneu de carro.
3. O cozimento de alimentos é mais rápido em maiores pressões.
4. Uma bola de basquete cheia no verão provavelmente terá aparência de mais vazia no inverno, mesmo que não tenha vazado ar.
Assinale a alternativa que apresenta a sequência correta na numeração das representações gráficas.
a) 1 – 3 – 4 – 2.
b) 2 – 3 – 4 – 1.
c) 4 – 2 – 1 – 3.
d) 4 – 3 – 1 – 2.
e) 2 – 4 – 3 – 1.
Física II ⇒ (UFPR - 2014/1ªFase) Termologia - Gases Tópico resolvido
Moderador: [ Moderadores TTB ]
- jrneliodias

- Mensagens: 2578
- Registrado em: 16 Jun 2012, 17:15
- Última visita: 23-05-22
- Localização: Belém - PA
- Agradeceu: 512 vezes
- Agradeceram: 1220 vezes
Out 2015
29
12:28
Re: (UFPR - 2014/1ªFase) Termologia - Gases
Olá, mlcosta.
No diagrama pressão por volume, teremos a afirmação 2 como resposta, pois o pneu de carro tem um volume maior que da bicicleta, então precisaríamos de uma pressão menor para enchê-lo que para um bicicleta.
No diagrama pressão e temperatura, teremos a afirmação 3, porque quanto maior a pressão, maior a temperatura para o líquido vaporizar.
No volume e temperatura, teremos a afirmação 4, já que se diminuirmos a temperatura, teremos um volume menor.
Por último, volume e quantidade de matéria, a afirmação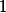 é a correta, pois para termos um mesmo volume de gás, teremos o mesmo número de mols, mesmo não possuindo a mesma massa.
é a correta, pois para termos um mesmo volume de gás, teremos o mesmo número de mols, mesmo não possuindo a mesma massa.
Portanto, letra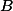 .
.
Espero ter ajudado, abraço.
No diagrama pressão por volume, teremos a afirmação 2 como resposta, pois o pneu de carro tem um volume maior que da bicicleta, então precisaríamos de uma pressão menor para enchê-lo que para um bicicleta.
No diagrama pressão e temperatura, teremos a afirmação 3, porque quanto maior a pressão, maior a temperatura para o líquido vaporizar.
No volume e temperatura, teremos a afirmação 4, já que se diminuirmos a temperatura, teremos um volume menor.
Por último, volume e quantidade de matéria, a afirmação
Portanto, letra
Espero ter ajudado, abraço.
Editado pela última vez por jrneliodias em 29 Out 2015, 12:28, em um total de 2 vezes.
Para alcançar um objetivo, não procure motivação, busque a disciplina. Ela que irá fazer você levantar todos os dias para realizar seus sonhos. A motivação é o resultado, é o que sente no final do dia, quando deitar sua cabeça no travesseiro.
- mlcosta

- Mensagens: 286
- Registrado em: 13 Nov 2014, 12:20
- Última visita: 19-05-24
- Agradeceu: 66 vezes
- Agradeceram: 12 vezes
Nov 2015
04
10:37
Re: (UFPR - 2014/1ªFase) Termologia - Gases
Olá Nélio Dias, queria agradecer pela sua ajuda. Bate com o gabarito e entendi sua analise para cada alternativa. Valeu!!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 2 Respostas
- 3041 Exibições
-
Última mensagem por mlcosta
-
- 2 Respostas
- 1576 Exibições
-
Última mensagem por snooplammer
-
- 2 Respostas
- 2283 Exibições
-
Última mensagem por amy123369
-
- 1 Respostas
- 3166 Exibições
-
Última mensagem por A13235378
-
- 1 Respostas
- 1073 Exibições
-
Última mensagem por A13235378
