De uma solução de KOH retirou-se uma alíquota de 25 mL. Juntou-se água e fenolftaleína e, em seguida, titulou-se com 17 mL de uma solução de HCl 0,10 mol/L. Calcular a concentração em g/L da solução de KOH.
• KOH (PM = 56,11)
Química Geral ⇒ Volumetria
- filipe231

- Mensagens: 18
- Registrado em: 19 Nov 2014, 16:28
- Última visita: 17-12-14
- Agradeceu: 5 vezes
Nov 2014
25
17:46
Volumetria
Editado pela última vez por poti em 26 Nov 2014, 03:21, em um total de 1 vez.
Razão: Alterar Título
Razão: Alterar Título
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2014
26
08:19
Re: Volumetria
A equação química do processo:
}+HC\ell_{(aq)} \rightarrow NaC\ell_{(aq)}+ H_2O_{(\ell)})
O número de mols) utilizado foi de:
utilizado foi de:
_{HC\ell}) , onde
, onde  é a concentração molar da solução de ácido.
é a concentração molar da solução de ácido.

Como os coeficientes estequiométricos da reação são 1 : 1, o número de mols de KOH que havia em solução também é 0,0017 mol.
A massa de KOH em solução será de:



=\frac{m_{KOH}}{V(\ell)}=\frac{0,095387}{0,025}=3,82 \ g/\ell)
Espero ter ajudado!
O número de mols
Como os coeficientes estequiométricos da reação são 1 : 1, o número de mols de KOH que havia em solução também é 0,0017 mol.
A massa de KOH em solução será de:
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 26 Nov 2014, 08:19, em um total de 1 vez.
So many problems, so little time!
- filipe231

- Mensagens: 18
- Registrado em: 19 Nov 2014, 16:28
- Última visita: 17-12-14
- Agradeceu: 5 vezes
Nov 2014
27
09:17
Re: Volumetria
E como eu faria se a questão apresentasse apenas o valor do KOH em gramas ao invés de mol/l. Como eu faria pra achar seu valor em mol/l?
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2014
27
09:27
Re: Volumetria
Eu não sei se entendi sua pergunta, mas veja:
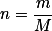
n é o número de mols;
m é a massa em gramas da substância;
M é a massa molar da substância.
A reação entre mol e massa em gramas é a massa molar M.
A concentração molar é dada por:
Note que é a concentração em g/L, então:
é a concentração em g/L, então:

Espero ter ajudado!
n é o número de mols;
m é a massa em gramas da substância;
M é a massa molar da substância.
A reação entre mol e massa em gramas é a massa molar M.
A concentração molar é dada por:
Note que
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 27 Nov 2014, 09:27, em um total de 1 vez.
So many problems, so little time!
- filipe231

- Mensagens: 18
- Registrado em: 19 Nov 2014, 16:28
- Última visita: 17-12-14
- Agradeceu: 5 vezes
Nov 2014
28
16:47
Re: Volumetria
Tipo essa questão onde ele dá apenas a massa em gramas do hidrocarbonato de sódio, a minha dificuldade é em montar as fórmulas.
6. Uma amostra de 0,4671 g contendo hidrogenocarbonato de sódio foi dissovida e titulada com 40,72 mL de uma solução padrão de HCl 0,1067 M. Sabendo que a reacção é
HCO3- + H+ -> H2O + CO2
calcule a percentagem de bicarbonato de sódio na amostra
6. Uma amostra de 0,4671 g contendo hidrogenocarbonato de sódio foi dissovida e titulada com 40,72 mL de uma solução padrão de HCl 0,1067 M. Sabendo que a reacção é
HCO3- + H+ -> H2O + CO2
calcule a percentagem de bicarbonato de sódio na amostra
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Dez 2014
01
10:12
Re: Volumetria
Vamos reescrever essa reação do seguinte modo:
}+HC\ell_{(aq)} \rightarrow NaC\ell_{(aq)}+H_2O_{(\ell)}+CO_2_{(g)})
Temos que
Veja que a quantidade de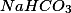 está dada em gramas, pode-se usar esse valor para se relacionar com a massa, em gramas, de HCl que se utilizou, mas como achamos o números de mols de ácido, fica mais fácil achar inicialmente quantos mols de
está dada em gramas, pode-se usar esse valor para se relacionar com a massa, em gramas, de HCl que se utilizou, mas como achamos o números de mols de ácido, fica mais fácil achar inicialmente quantos mols de 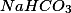 reagiram.
reagiram.
Note que 1 mol de sal reagem com um mol de ácido, então, reagiram 0,004345 mol de sal.
Sabemos que



A amostra tinha 0,4671 g e apenas 0,365 é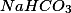 , então a porcentagem de
, então a porcentagem de 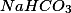 pode ser obtida por:
pode ser obtida por:

Espero ter ajudado!
Temos que
Veja que a quantidade de
Note que 1 mol de sal reagem com um mol de ácido, então, reagiram 0,004345 mol de sal.
Sabemos que
A amostra tinha 0,4671 g e apenas 0,365 é
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 01 Dez 2014, 10:12, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Resp.
- Exibições
- Últ. msg
-
- 1 Resp.
- 10398 Exibições
-
Últ. msg por VALDECIRTOZZI
-
- 4 Resp.
- 1124 Exibições
-
Últ. msg por filipe231
-
- 3 Resp.
- 4843 Exibições
-
Últ. msg por filipe231
-
- 2 Resp.
- 2206 Exibições
-
Últ. msg por vics
-
- 1 Resp.
- 745 Exibições
-
Últ. msg por VALDECIRTOZZI
