0-0) Temos que a molalidade
)
é dada por:

, onde

é o número de mols do soluto

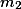
é a massa dosolvente em quilogramas

.

1-1) A molaridade
)
é dada por:

, onde

é o número de mols do soluto
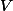
em litros da solução
Para soluções infinitamente diluídas, podemos considerar que todo o volume da solução é devido ao solvente (água). Como a densidade da água é

, temos que sua massa e volume são numericamente iguais, e, com isso,

3-3) Como acima

:

de
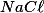
.
Agora,em solução aquosa, o
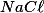
se dissocia:
} \rightarrow Na^{+}_{(aq)}+C\ell^{-}_{(aq)})
Então para cada mol de
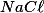
há a formação de 2 mols de íons, portanto para

mol de
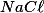
há formação de

mol de íons.
4-4) Como visto acima, a molaridade depende do volume da solução, e o volume é função da temperatura, ou seja, o volume varia com a temperatura. A molaridade é usada em análises quantitativas, mas depende da temperatura (ou seja para ambiente com variações amplas de temperatura, a molaridade muda). Para trabalhos que necessitam de alto grau de precisão, utiliza-se a molalidade, pois esta depende apenas de massas que são invariáveis com a temperatura.
Espero ter ajudado!


