Com relação às espécies abaixo, a afirmativa ERRADA é:
A) Entre O2- , F- e Ne, a última possui o menor raio.
B) Entre Na, Al e Cl, a última possui a maior eletronegatividade.
C) Entre Na+ , Mg+ e Ne, a última possui a maior energia de ionização.
D) Entre N, O e F, a última possui, em módulo, a maior afinidade eletrônica.
Gabarito C.
a) Percebi que esses íons bem como o átomo de Ne apresentam todos dez elétrons. Íons que apresentam o mesmo número de elétrons são chamados de íons isoeletrônicos.
Como o Ne não é um íon posso dizer que essa é uma série isoeletrônica?
Em uma série isoeletrônica, quanto maior o número atômico, menor o tamanho do átomo, assim como o elemento Ne possui maior Z ele terá o menor raio.
b) Sendo a eletronegatividade a propriedade pela qual o átomo apresenta maior ou menor tendência em atrair elétrons para si, essa alternativa fica fácil.
c) Sei que energia de ionização é a medida de energia fornecida a um átomo isolado no estado gasoso para retirar um elétron, formando um íon gasoso positivo.
O Neônio é um gás nobre, ou seja, ele é muito estável tem o octeto completo. Creio que a energia para retirar um elétron desse átomo seja a maior. Mesmo comparada a 2ª energia de ionização do sódio e a terceira energia de ionização do Magnésio, que afinal, aumenta bastante devido a mudança de camada eletrônica.
Como fazer esta análise?
d) Afinidade eletrônica é a medida de energia liberada pelo átomo isolado no estado gasoso ao receber um elétron, formando um íon gasoso negativo. Ele usou a palavra módulo para não confundir o aluno, uma vez que, a energia liberada é sempre negativa. Como o flúor libera uma maior quantidade energia, pensando em cálculos matemáticos o aluno poderia confundir ao achar que, por exemplo, -122 Kcal/mol é menor -121 Kcal/mol. É isso?
Química Geral ⇒ (FCMMG-2006) Propriedades dos elementos Tópico resolvido
Moderador: [ Moderadores TTB ]
Abr 2012
13
14:07
(FCMMG-2006) Propriedades dos elementos
Última edição: Diegooo (Sex 13 Abr, 2012 14:07). Total de 2 vezes.
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Abr 2012
13
14:45
Re: Propriedades dos elementos
A) A espécie 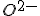 possui
possui 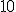 elétrons e sua configuração eletrônica fica: K=2 L=8.
elétrons e sua configuração eletrônica fica: K=2 L=8.
A espécie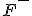 tembém possui
tembém possui 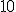 elétrons e sua configuração eletrônica fica: K=2 L =8.
elétrons e sua configuração eletrônica fica: K=2 L =8.
O possui também
possui também 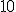 elétrons e sua configuração eletrônica fica: K = 2 L=8.
elétrons e sua configuração eletrônica fica: K = 2 L=8.
Todas as espécies apresentam o mesmo número de elétrons, portanto, são isoeletrônicas. Agora o apresenta uma carga nuclear de 10 prótons ou seja, ele "puxa" com mais força a nuvem eletrônica que os íons
apresenta uma carga nuclear de 10 prótons ou seja, ele "puxa" com mais força a nuvem eletrônica que os íons 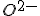 e
e 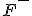 , já que estes possuem menos prótons. Esse efeito diminui o raio atômico.
, já que estes possuem menos prótons. Esse efeito diminui o raio atômico.
C) Tanto o íon sódio, o íon magnésio e o neônio possuem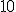 elétrons na eletrosfera e suas últimas camadas estão completas. Agora o íon sódio tem carga nuclear com
elétrons na eletrosfera e suas últimas camadas estão completas. Agora o íon sódio tem carga nuclear com 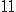 prótons e o íon magnésio tem carga nuclear com
prótons e o íon magnésio tem carga nuclear com 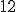 prótons. Veja que a carga nuclear do neônio é apenas de
prótons. Veja que a carga nuclear do neônio é apenas de 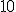 prótons , o que faz a atração pela sua nuvem eletrônica ser menor que a atração dos respectivos íons, por isso é mais fácil (gastar menos energia) retirar um elétron do neônio que dos íons em questão.
prótons , o que faz a atração pela sua nuvem eletrônica ser menor que a atração dos respectivos íons, por isso é mais fácil (gastar menos energia) retirar um elétron do neônio que dos íons em questão.
D) Talvez seja mais fácil entender a afinidade eletrônica como a tendência que uma espécie química tem de receber elétrons. Quanto mais a espécie quer elétrons, maior será a energia liberada, pois mais estável (situação de menor conteúdo energético) a espécie se torna. No caso, o flúor é muito reativo (e o elemento mais eletronegativo) e está "louco" para se estabilizar com o octeto, portanto ele libera a maior quantidade de energia quando recebe um elétron.
Espero ter ajudado.
A espécie
O
Todas as espécies apresentam o mesmo número de elétrons, portanto, são isoeletrônicas. Agora o
C) Tanto o íon sódio, o íon magnésio e o neônio possuem
D) Talvez seja mais fácil entender a afinidade eletrônica como a tendência que uma espécie química tem de receber elétrons. Quanto mais a espécie quer elétrons, maior será a energia liberada, pois mais estável (situação de menor conteúdo energético) a espécie se torna. No caso, o flúor é muito reativo (e o elemento mais eletronegativo) e está "louco" para se estabilizar com o octeto, portanto ele libera a maior quantidade de energia quando recebe um elétron.
Espero ter ajudado.
Última edição: VALDECIRTOZZI (Sex 13 Abr, 2012 14:45). Total de 1 vez.
So many problems, so little time!
Abr 2012
13
17:44
Re: Propriedades dos elementos
Excelente explicação, entendi perfeitamente!
Vacilei! O neônio está no 2 período, ou seja, duas camadas eletrônicas. Quando (Na) perde 1 elétron e o (Mg) perde 2 elétrons eles também apresentarão duas camadas eletrônicas com octeto completo. Porém, como o Mg tem maior carga nuclear ele terá a maior energia de ionização.
Obrigado! Ajudou bastante.
Vacilei! O neônio está no 2 período, ou seja, duas camadas eletrônicas. Quando (Na) perde 1 elétron e o (Mg) perde 2 elétrons eles também apresentarão duas camadas eletrônicas com octeto completo. Porém, como o Mg tem maior carga nuclear ele terá a maior energia de ionização.
Obrigado! Ajudou bastante.
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 1 Respostas
- 1708 Exibições
-
Última msg por emersonnasc
-
- 1 Respostas
- 814 Exibições
-
Última msg por petras
-
- 0 Respostas
- 702 Exibições
-
Última msg por robertta
-
- 2 Respostas
- 558 Exibições
-
Última msg por Ornitologo
-
- 1 Respostas
- 4347 Exibições
-
Última msg por Carlosft57








