Química Geral ⇒ Grau de Dissociação Tópico resolvido
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Jun 2016
29
16:37
Grau de Dissociação
Calcule o grau de dissociação e constante de basicidade ) de uma solução de
de uma solução de  de
de 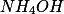 , cujo
, cujo 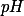 é igual a
é igual a 
Editado pela última vez por Cientista em 29 Jun 2016, 16:37, em um total de 1 vez.
Força e bons estudos!
- Gauss

- Mensagens: 726
- Registrado em: 20 Jun 2015, 19:25
- Última visita: 11-10-23
- Agradeceu: 222 vezes
- Agradeceram: 179 vezes
Jun 2016
29
17:25
Re: Grau de Dissociação
Perceba que o grau de dissociação é muito pequeno, então, podemos dizer que a concentração de hidróxido de amônio praticamente não se alterou, uma vez que a base sofreu uma dissociação pequena.
Obs: Normalmente os livros trazem a informação de que a constante de equilíbrio é uma grandeza adimensional, no entanto, se olharmos o cálculo do
Editado pela última vez por Gauss em 29 Jun 2016, 17:25, em um total de 1 vez.
- Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Jun 2016
29
18:10
Re: Grau de Dissociação
Obrigado colega Gauss !
Por acaso, não conhecia essa fórmula de Grau dissociação, desse jeito por quantidades, você mesmo que deduzio?
E por que é põe a concentração em unidade "N" se sabemos que é "M" ?
Por acaso, não conhecia essa fórmula de Grau dissociação, desse jeito por quantidades, você mesmo que deduzio?
E por que é põe a concentração em unidade "N" se sabemos que é "M" ?
Força e bons estudos!
- Gauss

- Mensagens: 726
- Registrado em: 20 Jun 2015, 19:25
- Última visita: 11-10-23
- Agradeceu: 222 vezes
- Agradeceram: 179 vezes
Jun 2016
29
21:10
Re: Grau de Dissociação
Olá, Cientista!
Com relação a fórmula, eu a vi no livro do Ricardo Feltre de físico-química. Mas, se olharmos bem, ela é uma regra de 3 comum.
[tex3]100%\ ----\ 0,05\ M\\\\\alpha \ ------\ 0,001\ M\\\\\alpha =2\ %[/tex3]
Com relação a unidade apresentada pelo exercício, penso que seja um erro e que o correto seja M de molar mesmo.
Com relação a fórmula, eu a vi no livro do Ricardo Feltre de físico-química. Mas, se olharmos bem, ela é uma regra de 3 comum.
[tex3]100%\ ----\ 0,05\ M\\\\\alpha \ ------\ 0,001\ M\\\\\alpha =2\ %[/tex3]
Com relação a unidade apresentada pelo exercício, penso que seja um erro e que o correto seja M de molar mesmo.
Editado pela última vez por Gauss em 29 Jun 2016, 21:10, em um total de 1 vez.
-
- Tópicos Semelhantes
- Resp.
- Exibições
- Últ. msg
-
- 1 Resp.
- 1437 Exibições
-
Últ. msg por VALDECIRTOZZI
-
- 1 Resp.
- 1936 Exibições
-
Últ. msg por Nietzsche
-
- 2 Resp.
- 1653 Exibições
-
Últ. msg por Tassandro
-
- 3 Resp.
- 1076 Exibições
-
Últ. msg por Tassandro
-
- 1 Resp.
- 1090 Exibições
-
Últ. msg por Tassandro
