Em um calorímetro adiabático, com capacidade térmica desprezível, são introduzidos, sob pressão constante de 1 atm, um volume V1 de solução aquosa 1,0 molar de ácido clorídrico e um volume V2 de solução aquosa 1,0 molar de hidróxido de sódio. A reação que ocorre é aquele representada pela equação química:
[tex3]H^{+}[/tex3]
(aq) + [tex3]OH^{-}[/tex3]
(aq) → [tex3]H_{2} O[/tex3]
(l)
As misturas efetuadas são as seguintes:
I- V1 = 100 ml e V2 = 100 ml e observa-se um aumento de temperatura ∆T1.
II- V1 = 50 ml e V2 = 150 ml e observa-se um aumento de temperatura ∆T2.
III- V1 = 50 ml e V2 = 50 ml e observa-se um aumento de temperatura ∆T3.
Com relação ao efeito térmico que se observa, é correto
prever que:
a) ∆T1 ≅ ∆T3 > ∆T2
b) ∆T1 > ∆T2 > ∆T3
c) ∆T1 > ∆T2 ≅ ∆T3
d) ∆T1 > ∆T3 > ∆T2
e) ∆T1 ≅ ∆T3 ≅ ∆T2
IME/ITA ⇒ (ITA 1995) Termoquimica
- kevin22

- Mensagens: 63
- Registrado em: 04 Out 2013, 07:21
- Última visita: 16-02-17
- Agradeceram: 3 vezes
Ago 2014
23
18:21
(ITA 1995) Termoquimica
Editado pela última vez por kevin22 em 23 Ago 2014, 18:21, em um total de 1 vez.
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Ago 2014
25
10:35
Re: (ITA 1995) Termoquimica
Creio que a solução seja a seguinte:
A reação de neutralização entre um ácido e uma base forte exotérmica e assumamos a reação de neutralização entre 1 mol acido forte e 1 mol de base forte, formando água líquida tenha uma variação de entalpia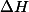 em kJ/mol de água
em kJ/mol de água
No caso I, houve a reação de de 0,1 mol de ácido com 0,1 mol de base, formando 0,1 mol de água. A energia liberada será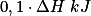 . Como o volume total da solução é
. Como o volume total da solução é 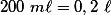 , temos que a quantidade de calor liberada por litro de solução será:
, temos que a quantidade de calor liberada por litro de solução será: 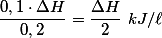 .
.
No caso II, houve a reação de de 0,05 mol de ácido com 0,15 mol de base, formando 0,05 mol de água. A energia liberada será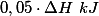 . Como o volume total da solução é
. Como o volume total da solução é 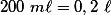 , temos que a quantidade de calor liberada por litro de solução será:
, temos que a quantidade de calor liberada por litro de solução será: 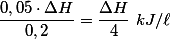 .
.
No caso III, houve a reação de de 0,05 mol de ácido com 0,05 mol de base, formando 0,05 mol de água. A energia liberada será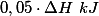 . Como o volume total da solução é
. Como o volume total da solução é 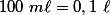 , temos que a quantidade de calor liberada por litro de solução será:
, temos que a quantidade de calor liberada por litro de solução será: 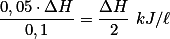 .
.
Dessa forma, é possível concluir que a alternativa A é a correta.
Espero ter ajudado!
A reação de neutralização entre um ácido e uma base forte exotérmica e assumamos a reação de neutralização entre 1 mol acido forte e 1 mol de base forte, formando água líquida tenha uma variação de entalpia
No caso I, houve a reação de de 0,1 mol de ácido com 0,1 mol de base, formando 0,1 mol de água. A energia liberada será
No caso II, houve a reação de de 0,05 mol de ácido com 0,15 mol de base, formando 0,05 mol de água. A energia liberada será
No caso III, houve a reação de de 0,05 mol de ácido com 0,05 mol de base, formando 0,05 mol de água. A energia liberada será
Dessa forma, é possível concluir que a alternativa A é a correta.
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 25 Ago 2014, 10:35, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Resp.
- Exibições
- Últ. msg
-
- 2 Resp.
- 4669 Exibições
-
Últ. msg por gabrielifce
-
- 3 Resp.
- 3267 Exibições
-
Últ. msg por viniciusrts
-
- 1 Resp.
- 2306 Exibições
-
Últ. msg por VALDECIRTOZZI
-
- 1 Resp.
- 1881 Exibições
-
Últ. msg por Jigsaw
-
- 6 Resp.
- 6164 Exibições
-
Últ. msg por LET
