Quando é alcançado o equilíbrio:
2[tex3]NO_{2}[/tex3] (g)[tex3]{\color{blue} \rightarrow }[/tex3][tex3]N_{2}O_{4}[/tex3] (g),
equilíbrio
a pressão é 2 atm e há 50% de [tex3]NO_{2}[/tex3] em volume. O valor da constante de equilíbrio em pressões parciais (Kp) deve ser:
Resp:. 1[tex3]atm^{-1}[/tex3]
Química Geral ⇒ (SANTOS-SP) Constante de Equilíbrio
- pklaskoski

- Mensagens: 104
- Registrado em: 28 Jun 2014, 14:19
- Última visita: 24-07-17
- Agradeceu: 65 vezes
- Agradeceram: 5 vezes
Jul 2014
26
12:53
(SANTOS-SP) Constante de Equilíbrio
Editado pela última vez por pklaskoski em 26 Jul 2014, 12:53, em um total de 2 vezes.
- VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Ago 2014
01
11:13
Re: (SANTOS-SP) Constante de Equilíbrio
Temos o equilíbrio:
} \rightleftharpoons N_2O_4_{(g)})
Suponhemos que inicialmente há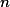 mols de
mols de  e que se dissociem [tex3]\alpha[/tex3]
mols desse gás, então:
e que se dissociem [tex3]\alpha[/tex3]
mols desse gás, então:
Início: e
e  .
.
Dissociam: e formam
e formam  .
.
No equilíbrio há: e
e  .
.
O número de mols total no equilíbrio será:
Pelos dados do problema, o número de mols de é 50% desse valor:
é 50% desse valor:
)


Então no equilíbrio há:
}=n-2\alpha =3\alpha -2\alpha =\alpha)
}=\alpha)
E o número total de mols no equilíbrio será:
A fração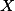 do
do  no equilíbrio será:
no equilíbrio será:
}=\frac{n_{(NO_2)}}{n_{(total)}})
}=\frac{\alpha }{2\alpha } =\frac{1}{2})
A fração molar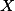 do
do  no equilíbrio será:
no equilíbrio será:
}=\frac{n_{(N_2O_4)}}{n_{(total)}})
}=\frac{\alpha }{2\alpha }= \frac{1}{2})
A expressão da constante de equilíbrio:
}}{p^2_{(NO_2)}}=\frac{X_{(N_2O_4)}\cdot P}{\left(X_{(NO_2)} \cdot P\right)^2})
^2}=1 \ atm^{-1})
Espero ter ajudado!
Suponhemos que inicialmente há
Início:
Dissociam:
No equilíbrio há:
O número de mols total no equilíbrio será:
Pelos dados do problema, o número de mols de
Então no equilíbrio há:
E o número total de mols no equilíbrio será:
A fração
A fração molar
A expressão da constante de equilíbrio:
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 01 Ago 2014, 11:13, em um total de 2 vezes.
So many problems, so little time!
-
- Tópicos Semelhantes
- Resp.
- Exibições
- Últ. msg
-
- 1 Resp.
- 1202 Exibições
-
Últ. msg por FelipeMartin
-
- 1 Resp.
- 1053 Exibições
-
Últ. msg por roberto
-
- 0 Resp.
- 1554 Exibições
-
Últ. msg por haydenchars
-
- 3 Resp.
- 1317 Exibições
-
Últ. msg por Matheusrpb
-
- 1 Resp.
- 1073 Exibições
-
Últ. msg por petras
