Olá, Comunidade!
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero )
)
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
IME/ITA ⇒ (IME) Efusão de gases Tópico resolvido
Moderador: [ Moderadores TTB ]
-
BushJunior

- Mensagens: 141
- Registrado em: 16 Dez 2012, 18:05
- Última visita: 14-02-16
- Agradeceu: 18 vezes
- Agradeceram: 5 vezes
Jul 2013
03
13:13
(IME) Efusão de gases
Um cilindro contendo oxigênio puro teve sua pressão reduzida de 2,6atm para 2 atm, em 47 min, devido a um vazamento através de um pequeno orifício existente. Quando cheio com outro gás, n mesma pressão inicial, levou 55,1 min para que a pressão caísse outra vez ao valor de 2 atm.Determine a massa molecular do segundo gás.Considere que ambos os processos foram isotérmicos e à mesma temperatura, e que os gases nestas condições de pressão e temperatura apresentam comportamento ideal.
“Bem, todos morrem um dia, é simples matemática. Nada de novo. A espera é que é um problema”. (Charles Bukowski)
-
Radius

- Mensagens: 1237
- Registrado em: 08 Set 2012, 21:30
- Última visita: 09-01-21
- Agradeceu: 342 vezes
- Agradeceram: 746 vezes
Jul 2013
04
15:52
Re: (IME) Efusão de gases
Para o oxigênio a velocidade é:
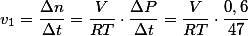
Similarmente, para o outro gás a velocidade é
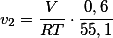
------
Substituindo na equação
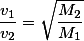
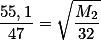
Vamos achar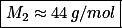
Similarmente, para o outro gás a velocidade é
------
Substituindo na equação
Vamos achar
Editado pela última vez por Radius em 04 Jul 2013, 15:52, em um total de 1 vez.
-
BushJunior

- Mensagens: 141
- Registrado em: 16 Dez 2012, 18:05
- Última visita: 14-02-16
- Agradeceu: 18 vezes
- Agradeceram: 5 vezes
Jul 2013
05
09:01
Re: (IME) Efusão de gases
Não compreendi muito bem a equação v1, vc poderia me explicar como chegar nela ?
“Bem, todos morrem um dia, é simples matemática. Nada de novo. A espera é que é um problema”. (Charles Bukowski)
-
Radius

- Mensagens: 1237
- Registrado em: 08 Set 2012, 21:30
- Última visita: 09-01-21
- Agradeceu: 342 vezes
- Agradeceram: 746 vezes
Jul 2013
05
09:34
Re: (IME) Efusão de gases
bom, a velocidade pode ser em metros por segundo, metros cúbicos por segundo, atmosferas por segundo, qualquer coisa.
No caso eu preferi usar mols/segundo. Usando Clapeyron, com V, R e T constantes:
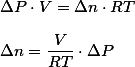
então a velocidade do oxigênio é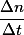 . Entendido?
. Entendido?
No caso eu preferi usar mols/segundo. Usando Clapeyron, com V, R e T constantes:
então a velocidade do oxigênio é
Editado pela última vez por Radius em 05 Jul 2013, 09:34, em um total de 1 vez.
-
BushJunior

- Mensagens: 141
- Registrado em: 16 Dez 2012, 18:05
- Última visita: 14-02-16
- Agradeceu: 18 vezes
- Agradeceram: 5 vezes
Jul 2013
05
14:30
Re: (IME) Efusão de gases
Acredito que dê para fazer pelas leis de Graham de efusão.
[tex3]\frac{V1}{V2}[/tex3] = ([tex3]\sqrt{\frac{M2}{M1}}[/tex3] )
[tex3]\frac{V1}{V2} = \frac{t2}{t1}[/tex3] (como são grandezas inversamente proporcionais)
[tex3]\frac{t2}{t1} = \sqrt{\frac{M2}{M1}}[/tex3]
Substituí aqui e deu 43,980 g/mol.
[tex3]\frac{V1}{V2}[/tex3] = ([tex3]\sqrt{\frac{M2}{M1}}[/tex3] )
[tex3]\frac{V1}{V2} = \frac{t2}{t1}[/tex3] (como são grandezas inversamente proporcionais)
[tex3]\frac{t2}{t1} = \sqrt{\frac{M2}{M1}}[/tex3]
Substituí aqui e deu 43,980 g/mol.
Editado pela última vez por BushJunior em 05 Jul 2013, 14:30, em um total de 1 vez.
“Bem, todos morrem um dia, é simples matemática. Nada de novo. A espera é que é um problema”. (Charles Bukowski)
-
BushJunior

- Mensagens: 141
- Registrado em: 16 Dez 2012, 18:05
- Última visita: 14-02-16
- Agradeceu: 18 vezes
- Agradeceram: 5 vezes
Jul 2013
05
14:32
Re: (IME) Efusão de gases
Entendi sim, obrigado.
“Bem, todos morrem um dia, é simples matemática. Nada de novo. A espera é que é um problema”. (Charles Bukowski)
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 2 Respostas
- 1615 Exibições
-
Última mensagem por fmatheus
-
- 1 Respostas
- 948 Exibições
-
Última mensagem por eivitordias
-
- 1 Respostas
- 1229 Exibições
-
Última mensagem por eivitordias






