Olá Leandro;
Leandro escreveu:Só não entendo por que a concentração do cátion cobre é unitária!
Observe o enunciado:
Dados: Potenciais de eletrodo padrão do cobre-sulfato de cobre e do alumínio , na escala do eletrodo
de hidrogênio, nas
condições-padrão
Ou seja, fixando o valor de temperatura em 25ºC e a concentração de solução em
1mol/L. O potencial medido nessas condições e a 1 atm de pressão é denominado potencial padrão de eletrodo.
Simplesmente por isso!
___________________________//___________________________
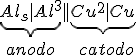
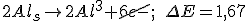

_________________________________________________________________
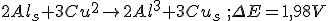
Considerando o eletrodo de referência o eletrodo cobre-sulfato de cobre temos que o potencial de redução do cátion alumínio será
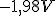
, pois:
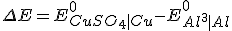

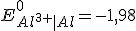
Então;
![E=E\º+\frac{0,059}{n}\cdot log [\,\,\,\,\,] E=E\º+\frac{0,059}{n}\cdot log [\,\,\,\,\,]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?E=E%5C%C2%BA+%5Cfrac%7B0,059%7D%7Bn%7D%5Ccdot%20log%20%5B%5C,%5C,%5C,%5C,%5C,%5D)
)
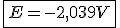
Perceba que você nem precisaria usar concentração de 1 mol/L pros cátions cobre.
Espero ter ajudado!


