Helloguys23 escreveu: ↑Dom 25 Ago, 2019 20:59
Sabendo que em determinadas condições de temperatura e pressão 3.01*10^20 moléculas de um gás ocupam 2*10^-2 L,qual será o volume molar nessas condições?
POR FAVOR,MOSTRE A RESOLUÇÃO DESSA QUESTÃO.
Helloguys23, primeiro indicamos a definição de volume molar:
Volume molar de gases
QUÍMICA
O volume ocupado por um gás é diretamente proporcional à sua quantidade de moléculas (número de mol), considerando as mesmas condições de temperatura e pressão.
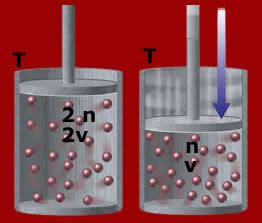
- volume molar de gases - B.E.jpg (10.4 KiB) Exibido 1309 vezes
Repare na ilustração acima, ambos os recipientes estão contidos com o mesmo gás e submetidos às mesmas condições de temperatura e pressão. Se diminuirmos o número de mol de 2 n para n, o volume também diminui: passa de 2V para V.
Com isso concluímos que a relação entre volume e número de mol é constante:
[tex3]\frac{V}{n}=K[/tex3]
Volume molar de gases: volume ocupado por um mol de qualquer gás, a uma determinada pressão e temperatura.
Volume molar = 22,4 L/mol
Esse valor é resultado de experimentos feitos em Condições Normais de Temperatura e Pressão (CNTP) – 1 atm e 273 K.
https://brasilescola.uol.com.br/quimica ... -gases.htm
Desta forma se 3.01*10^20 moléculas de um gás ocupam 2*10^-2 L, 6,02*10^23 moléculas (1 mol) ocuparão o Volume Molar:
[tex3]\boxed{VM=\frac{6,02\times10^{23}.2\times10^{-2}}{3,01\times10^{20}}=40\ L}[/tex3]
REFERÊNCIAS:
Volume molar de gases
https://brasilescola.uol.com.br/quimica ... -gases.htm

