Olá, Comunidade!
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero )
)
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Química Geral ⇒ Equilíbrio Químico
Moderador: [ Moderadores TTB ]
-
Cientista

- Mensagens: 1517
- Registrado em: 19 Mar 2013, 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Agradeceu: 698 vezes
- Agradeceram: 199 vezes
- Contato:
Jun 2016
28
11:52
Equilíbrio Químico
Considere o equilíbrio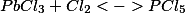 : como seria afectado a posição de equilíbrio:
: como seria afectado a posição de equilíbrio:
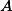) Pela adição de
Pela adição de 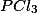 ?
?
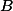) Pela remoção de
Pela remoção de 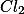 ?
?
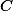) Pela remoção de
Pela remoção de 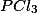 ?
?
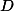) Pela diminuição do volume do recipiente?
Pela diminuição do volume do recipiente?
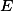) Pela adição de
Pela adição de 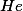 , sem variação de volume?
, sem variação de volume?
Editado pela última vez por Cientista em 28 Jun 2016, 11:52, em um total de 1 vez.
Força e bons estudos!
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Jun 2016
28
12:44
Re: Equilíbrio Químico
veja o sistema está em equilíbrio, ou seja, a velocidade de formação de reação dos reagentes para formar o produto é igual à velocidade de decomposição do produto para formar os reagentes.
Qual "mexida" nesse equilíbrio, o sistema reage tentando restabelecer o equilíbrio, aqui entra o Princípio de le Chatelier
A) A adição de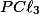 , aumenta sua concentração, então o sistema reage, consumindo mais
, aumenta sua concentração, então o sistema reage, consumindo mais 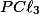 e deslocando a reação para a direita (formação de
e deslocando a reação para a direita (formação de 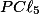 ).
).
B) A remoção de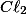 , diminui sua concentração, então o sistema reage, para aumentar sua concentração e se desloca para a esquerda, consumindo mais
, diminui sua concentração, então o sistema reage, para aumentar sua concentração e se desloca para a esquerda, consumindo mais 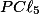 .
.
C) O mesmo efeito acima.
D) Veja que o sistema acima tem 2 volumes de gases na esquerda e 1 volume de gás à direita. Se eu diminuo o volume, há menos espaço para as moléculas, o sistema tenta compensar isso indo para o lado onde o volume é menor, ou seja, para a direita.
E) A introdução de um gás inerte que não reage com os gases presentes no sistema, não afeta o equilíbrio, pois o volumes parciais e pressões parciais dos gases reacionais não se alteram.
Espero ter ajudado!
Qual "mexida" nesse equilíbrio, o sistema reage tentando restabelecer o equilíbrio, aqui entra o Princípio de le Chatelier
A) A adição de
B) A remoção de
C) O mesmo efeito acima.
D) Veja que o sistema acima tem 2 volumes de gases na esquerda e 1 volume de gás à direita. Se eu diminuo o volume, há menos espaço para as moléculas, o sistema tenta compensar isso indo para o lado onde o volume é menor, ou seja, para a direita.
E) A introdução de um gás inerte que não reage com os gases presentes no sistema, não afeta o equilíbrio, pois o volumes parciais e pressões parciais dos gases reacionais não se alteram.
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 28 Jun 2016, 12:44, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 1 Respostas
- 1113 Exibições
-
Última mensagem por MicheleAlves
-
- 1 Respostas
- 1632 Exibições
-
Última mensagem por MicheleAlves
-
- 1 Respostas
- 3543 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 2657 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 2838 Exibições
-
Última mensagem por VALDECIRTOZZI
