Química Geral ⇒ Pilha eletroquímica Tópico resolvido
Moderador: [ Moderadores TTB ]
-
Cientista

- Mensagens: 1517
- Registrado em: Ter 19 Mar, 2013 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Contato:
Jun 2016
28
11:49
Pilha eletroquímica
Suponha que se forma uma célula electroquímica com base nos pares aq))
) e
e /Ag(s)) :
:
) Escreva a equação balanceada que representa a reação que leva a formação dos produtos favorecidos e calcule o respectivo potêncial da célula;
Escreva a equação balanceada que representa a reação que leva a formação dos produtos favorecidos e calcule o respectivo potêncial da célula;
) Qual é o ánodo e qual é o cátodo neste processo?
Qual é o ánodo e qual é o cátodo neste processo?
) Os electrões fluem do electrodo de zinco para o de prata ou vice-versa?
Os electrões fluem do electrodo de zinco para o de prata ou vice-versa?
) Se usar uma ponte contendo
Se usar uma ponte contendo 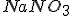 para ligar os dois compartimentos, em que direcção se movem os iões nitrato, do zinco para o lado da prata ou vice-versa?
para ligar os dois compartimentos, em que direcção se movem os iões nitrato, do zinco para o lado da prata ou vice-versa?
Última edição: Cientista (Ter 28 Jun, 2016 11:49). Total de 2 vezes.
Força e bons estudos!
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Jun 2016
28
12:07
Pilha eletroquímica
Cientista, você precisa fornecer o potencial de redução de cada semi-reação.
Última edição: VALDECIRTOZZI (Ter 28 Jun, 2016 13:09). Total de 1 vez.
Razão: Alteração do título
Razão: Alteração do título
So many problems, so little time!
-
Cientista

- Mensagens: 1517
- Registrado em: Ter 19 Mar, 2013 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Contato:
Jun 2016
28
12:10
Pilha eletroquímica
O enunciado não fornece
Última edição: VALDECIRTOZZI (Ter 28 Jun, 2016 13:10). Total de 1 vez.
Razão: Alteração do título
Razão: Alteração do título
Força e bons estudos!
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Jun 2016
28
13:05
Pilha eletroquímica
Tudo bem, vamos usar uma tabela padrão:
Semirreação de redução da prata:
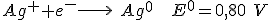
Semirreação de redução do zinco:
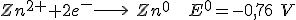
Observa-se então, que como o potencial de redução da prata é maior que o do zinco, ela reduz e o zinco oxida.
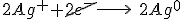

Somando as duas semirreações:
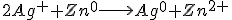
O potencial da célula é calculado por:

=1,56%20%5C%20V)
No cátodo sempre ocorre a redução, portanto é o eletrodo de prata.
No ânodo sempre ocorre a oxidação, portanto é o eletrodo de zinco.
Os elétrons fluem a partir de sua fonte: a cela zinco, que está se oxidando e liberando elétrons, para a cela de prata que necessita deles para se reduzir.
À medida que a reação se desenvolve, está havendo a oxidação do eletrodo de zinco. Com isso íons zinco passam para a solução, na forma de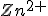 . A solução vai ficando com excesso de cargas positivas, alterando o equilíbrio elétrico. A ponte salina funciona para dar o equilíbrio elétrico necessário, então os íons nitrato, que são negativos
. A solução vai ficando com excesso de cargas positivas, alterando o equilíbrio elétrico. A ponte salina funciona para dar o equilíbrio elétrico necessário, então os íons nitrato, que são negativos 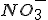 migram para a cela de zinco. O oposto ocorre na cela de cobro: para lá, migram os íons sódio
migram para a cela de zinco. O oposto ocorre na cela de cobro: para lá, migram os íons sódio  .
.
Espero ter ajudado!
Semirreação de redução da prata:
Semirreação de redução do zinco:
Observa-se então, que como o potencial de redução da prata é maior que o do zinco, ela reduz e o zinco oxida.
Somando as duas semirreações:
O potencial da célula é calculado por:
No cátodo sempre ocorre a redução, portanto é o eletrodo de prata.
No ânodo sempre ocorre a oxidação, portanto é o eletrodo de zinco.
Os elétrons fluem a partir de sua fonte: a cela zinco, que está se oxidando e liberando elétrons, para a cela de prata que necessita deles para se reduzir.
À medida que a reação se desenvolve, está havendo a oxidação do eletrodo de zinco. Com isso íons zinco passam para a solução, na forma de
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Ter 28 Jun, 2016 13:05). Total de 2 vezes.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 0 Respostas
- 737 Exibições
-
Última msg por Tutatá
-
- 0 Respostas
- 250 Exibições
-
Última msg por matheusM
-
- 0 Respostas
- 294 Exibições
-
Última msg por legislacao
-
- 2 Respostas
- 1093 Exibições
-
Última msg por Jigsaw
-
- 5 Respostas
- 1534 Exibições
-
Última msg por Madeline







