Equilíbrio Químico
Enviado: Seg 27 Jun, 2016 19:55
Numa solução aquosa 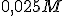 a
a 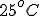 o
o 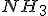 está ionizad a
está ionizad a 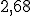 %, calcule:
%, calcule:
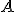) As concentrações de
As concentrações de 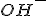 e
e 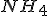 no equilibrio;
no equilibrio;
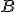) O
O 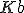 de
de 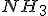 ;
;
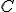) O
O 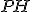 da solução
da solução
Fórum de Matemática, Português, Física, Química e Biologia para o vestibular, ensinos fundamental, médio e superior, concursos públicos e olimpíadas.
https://www.tutorbrasil.com.br/forum/
https://www.tutorbrasil.com.br/forum/viewtopic.php?f=14&t=50924