Creio que devamos fazer o seguinte:
Inicialmente a razão entres as constantes de equilíbrio são maiores que 10.000, logo, podemos assumir que a titulação de uma espécie só inicia quando a outra estiver sido totalmente titulada, por exemplo a titulação do
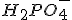
só se incia quando todo
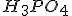
ter sido neutralizado pela base.
Temos então:
%7D%20%5Crightleftharpoons%20H_2PO_4_%7B(aq)%7D%5E-+H_%7B(aq)%7D%5E+)
![k_1=\frac{\left[H_{(aq)}^+\right] \cdot \left[H_2PO_4_{(aq)}^- \right]}{\left[H_3PO_4_{(aq)}\right]} k_1=\frac{\left[H_{(aq)}^+\right] \cdot \left[H_2PO_4_{(aq)}^- \right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?k_1=%5Cfrac%7B%5Cleft%5BH_%7B(aq)%7D%5E+%5Cright%5D%20%5Ccdot%20%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![\left[H_2PO_4_{(aq)}^- \right]=k_1\frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]} \left[H_2PO_4_{(aq)}^- \right]=k_1\frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D=k_1%5Cfrac%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D%7D)
Aplicando o logaritmo de ambos os membros da equação:
![\log \left[H_{(aq)}^+\right]=\log \left(k_1\frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]}\right) \log \left[H_{(aq)}^+\right]=\log \left(k_1\frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]}\right)](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cleft%5BH_%7B(aq)%7D%5E+%5Cright%5D=%5Clog%20%5Cleft(k_1%5Cfrac%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D%7D%5Cright))
![\log \left[H_{(aq)}^+\right]=\log k_1+\log \frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]} \log \left[H_{(aq)}^+\right]=\log k_1+\log \frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cleft%5BH_%7B(aq)%7D%5E+%5Cright%5D=%5Clog%20k_1+%5Clog%20%5Cfrac%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D%7D)
Multiplicando por
)
ambos os membro:
![-\log \left[H_{(aq)}^+\right]=-\log k_1- \log \frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]} -\log \left[H_{(aq)}^+\right]=-\log k_1- \log \frac{\left[H_3PO_4_{(aq)}\right]}{\left[H_2PO_4_{(aq)}^- \right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?-%5Clog%20%5Cleft%5BH_%7B(aq)%7D%5E+%5Cright%5D=-%5Clog%20k_1-%20%5Clog%20%5Cfrac%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%20%5Cright%5D%7D)
Por fim:
![pH=pk_1+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} pH=pk_1+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk_1+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
que é a equação de Henderson-Hasselbalch que rege os equilíbrio de tampão, que de fato temos.
Para
pH 1,62:
![pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![1,62=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 1,62=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?1,62=-%5Clog%207,60%20%5Ctimes%2010%5E%7B-3%7D+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![1,62=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 1,62=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?1,62=2,12+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=1,62-2,12 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=1,62-2,12](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=1,62-2,12)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=-0,5 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=-0,5](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=-0,5)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{-0,5} \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{-0,5}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=10%5E%7B-0,5%7D)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=0,32 \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=0,32](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=0,32)
Para
pH 2,12:
![pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![2,12=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 2,12=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?2,12=-%5Clog%207,60%20%5Ctimes%2010%5E%7B-3%7D+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![2,12=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 2,12=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?2,12=2,12+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=2,12-2,12 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=2,12-2,12](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=2,12-2,12)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=0 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=0](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=0)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{0} \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{0}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=10%5E%7B0%7D)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=1 \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=1](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=1)
Para
pH 6,21:
![pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} pH=pk+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![6,21=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 6,21=-\log 7,60 \times 10^{-3}+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?6,21=-%5Clog%207,60%20%5Ctimes%2010%5E%7B-3%7D+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![6,21=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]} 6,21=2,12+\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?6,21=2,12+%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=6,21-2,12 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=6,21-2,12](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=6,21-2,12)
![\log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=4,09 \log \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=4,09](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=4,09)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{4,09} \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=10^{4,09}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=10%5E%7B4,09%7D)
![\frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=12.303 \frac{\left[H_2PO_4_{(aq)}^-\right]}{\left[H_3PO_4_{(aq)}\right]}=12.303](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D%7B%5Cleft%5BH_3PO_4_%7B(aq)%7D%5Cright%5D%7D=12.303)
Note que para o próximo
pH= 7,21, todo
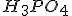
foi consumido e só resta
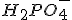
:
%7D%5E-%20%5Crightleftharpoons%20HPO_4_%7B(aq)%7D%5E%7B2-%7D+H_%7B(aq)%7D%5E+)
![pH=pk_2+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]} pH=pk_2+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk_2+%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D)
![7,21=7,21+\frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]} 7,21=7,21+\frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?7,21=7,21+%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D)
![\frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10^0=1 \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10^0=1](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D=10%5E0=1) pH=10,7
pH=10,7![pH=pk_2+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]} pH=pk_2+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk_2+%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D)
![10,7=\log 6,2 \times 10^{-8}+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]} 10,7=\log 6,2 \times 10^{-8}+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?10,7=%5Clog%206,2%20%5Ctimes%2010%5E%7B-8%7D+%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D)
![10,7=7,21+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]} 10,7=7,21+\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?10,7=7,21+%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D)
![\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10,7-7,21 \log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10,7-7,21](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D=10,7-7,21)
![\log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=3,49 \log \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=3,49](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D=3,49)
![\frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10^{3,49}=3.090 \frac{\left[HPO_4_{(aq)}^{2-} \right]}{\left[H_2PO_4_{(aq)}^-\right]}=10^{3,49}=3.090](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BHPO_4_%7B(aq)%7D%5E%7B2-%7D%20%5Cright%5D%7D%7B%5Cleft%5BH_2PO_4_%7B(aq)%7D%5E-%5Cright%5D%7D=10%5E%7B3,49%7D=3.090)
Espero ter ajudado!





