Alguém poderia me sugerir algum Pdf sobre Fórmulas Empíricas? REsolução de Exercícios, pois estou concorrendo para uma faculdade de Química Geral, e eles avaliam muitos exercícios de Fórmulas Empíricas pela qual tenho tido dificuldades. Agradeceria desde já !
Química Geral ⇒ Fórmula Empírica
Moderador: [ Moderadores TTB ]
-
Cientista

- Mensagens: 1517
- Registrado em: Ter 19 Mar, 2013 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Contato:
Abr 2016
13
08:25
Fórmula Empírica
Um dos gases  com a composição percentual de
com a composição percentual de 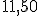 % de
% de  ,
, 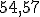 % de
% de  e
e 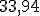 % de
% de  , tem a densidade de
, tem a densidade de  a
a  . Determine:
. Determine:
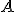) A Fórmula empírica, massa molecular e fórmula Molecular.
A Fórmula empírica, massa molecular e fórmula Molecular.
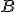) Se a massa molecular for de
Se a massa molecular for de  , qual é a sua fórmula Molecular?
, qual é a sua fórmula Molecular?
Alguém poderia me sugerir algum Pdf sobre Fórmulas Empíricas? REsolução de Exercícios, pois estou concorrendo para uma faculdade de Química Geral, e eles avaliam muitos exercícios de Fórmulas Empíricas pela qual tenho tido dificuldades. Agradeceria desde já !
Alguém poderia me sugerir algum Pdf sobre Fórmulas Empíricas? REsolução de Exercícios, pois estou concorrendo para uma faculdade de Química Geral, e eles avaliam muitos exercícios de Fórmulas Empíricas pela qual tenho tido dificuldades. Agradeceria desde já !
Última edição: Cientista (Qua 13 Abr, 2016 08:25). Total de 1 vez.
Força e bons estudos!
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Abr 2016
13
09:04
Re: Fórmula Empírica
pela equação de Clayperon para gases ideais:
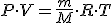

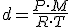
Nas CNTP:
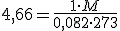
 esta é a massa molar, a massa molecular é 104,32 u.
esta é a massa molar, a massa molecular é 104,32 u.
Para 100 g do gás:
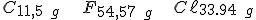
Dividindo pela massa atômica de cada átomo:
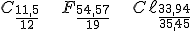
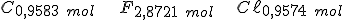
Dividindo pelo menor valor:

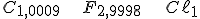
ou
 (fórmula empírica), cuja massa molar é:
(fórmula empírica), cuja massa molar é:  que é a mesma encontrada através do cálculo da densidade, logo a fórmula molecular é
que é a mesma encontrada através do cálculo da densidade, logo a fórmula molecular é  .
.
Veja para a massa molecular ser 62,1 u, há a necessidade de substituir o átomo e cloro e um átomo de flúor por carbono:
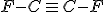 , a massa molecular fica:
, a massa molecular fica:
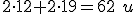
Espero ter ajudado!
Nas CNTP:
Para 100 g do gás:
Dividindo pela massa atômica de cada átomo:
Dividindo pelo menor valor:
ou
Veja para a massa molecular ser 62,1 u, há a necessidade de substituir o átomo e cloro e um átomo de flúor por carbono:
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Qua 13 Abr, 2016 09:04). Total de 1 vez.
So many problems, so little time!
-
Cientista

- Mensagens: 1517
- Registrado em: Ter 19 Mar, 2013 16:23
- Última visita: 14-04-17
- Localização: Moçambique-Maputo
- Contato:
Abr 2016
13
09:44
Re: Fórmula Empírica
Valeu !!!
PAra determinação da fórmula, empírica, eu não pudia simplesmente pegar as percentagens e dividir pela massa molar de cada elemento, depois pegar o valor mínimo etc..etc.. não teria a fórmula empirica?
Outra dúvida, fórmula empirica e molecular, na sua determinação não tem diferença? eu acho que vi em alguma resolução sua nos postes e tudo mais, que tu usavas uma incognita "n " para determinares a fórmula molecular de um composto
PAra determinação da fórmula, empírica, eu não pudia simplesmente pegar as percentagens e dividir pela massa molar de cada elemento, depois pegar o valor mínimo etc..etc.. não teria a fórmula empirica?
Outra dúvida, fórmula empirica e molecular, na sua determinação não tem diferença? eu acho que vi em alguma resolução sua nos postes e tudo mais, que tu usavas uma incognita "n " para determinares a fórmula molecular de um composto
Força e bons estudos!
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Abr 2016
13
10:52
Re: Fórmula Empírica
Aqui, no caso, a fórmula empírica e a fórmula molecular tem a mesma massa molar e, portanto, coincidem.
Creio que você se refere ao cálculo no número de mols (n):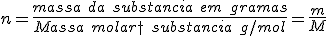 .
.
Dependo do problema, eu uso essa expressão que nos dá a relação entre essas três grandezas. Especificamente neste problema, ela foi usada na linha em que dividi, por exemplo a massa em gramas do carbono (e dos outros elementos), pela sua malar molar: .
.
Espero que tenha ficado claro!
Creio que você se refere ao cálculo no número de mols (n):
Dependo do problema, eu uso essa expressão que nos dá a relação entre essas três grandezas. Especificamente neste problema, ela foi usada na linha em que dividi, por exemplo a massa em gramas do carbono (e dos outros elementos), pela sua malar molar:
Espero que tenha ficado claro!
Última edição: VALDECIRTOZZI (Qua 13 Abr, 2016 10:52). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 1 Respostas
- 808 Exibições
-
Última msg por Jigsaw
-
- 1 Respostas
- 613 Exibições
-
Última msg por Jigsaw
-
- 0 Respostas
- 716 Exibições
-
Última msg por FISMAQUIM
-
- 3 Respostas
- 1124 Exibições
-
Última msg por Jigsaw
-
- 2 Respostas
- 1524 Exibições
-
Última msg por JuliaHubble







