(Ufrj 1999/Adaptada) Uma indústria química sediada na cidade do Rio de Janeiro lançava diretamente num rio as águas de despejo de três processos diferentes A, B e C. Um programa da Secretaria de Meio Ambiente, chamado Poluição Zero, obrigou esta indústria a tratar todas as águas residuais, de forma a eliminar totalmente a poluição por ela causada. Os dados referentes aos despejos A, B e C, bem como as novas exigências do programa Poluição Zero constam da tabela a seguir.
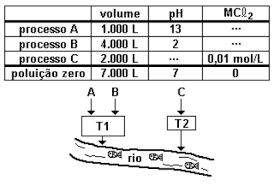
- download.png (14.7 KiB) Exibido 654 vezes
A empresa construiu então um sistema de tratamento em que as águas dos processos A e B são reunidas em um único tanque de neutralização T1 e a água do processo C, contaminada com metais pesados sob a forma de cloretos do tipo MCℓ2, é tratada em um tanque independente T2.
Considere as afirmações
I) A indústria dispõe de ácido clorídrico e hidróxido de sódio para o ajuste final do pH do tanque de neutralização T1. A massa, em gramas, de reagente necessária para a neutralização dos efluentes A + B é de 2190 g
II) O tratamento da água residual do processo C (tanque T2) com NaOH produz hidróxidos totalmente insolúveis. A massa, em gramas, de NaOH necessária para a eliminação total dos contaminantes segundo o programa Poluição Zero é de 1600g
Está(ão) correta(s):
a) Nenhum
b) I, apenas
c) II, apenas
d) I e II









