Na construção de barragens, usa-se o concreto. Nos primeiros dias de confecção, o concreto tem pH alcalino, o que protege a ferragem da oxidação. Com o tempo, o pH diminui pela carbonatação do concreto que se dá pela reação com o H2CO3.
Em um teste de carbonatação feito em laboratório, foi usada uma solução de H2CO3 de concentração 0,02 mol.L¢, a qual apresenta um grau de dissociação de 0,45%, a 25°C. O valor da primeira constante de ionização do H2CO3, nessa temperatura, é, aproximadamente,
a) 0,9 × [tex3]10^{-5}[/tex3]
b) 9 × [tex3]10^{-5}[/tex3]
c) 0,4 × [tex3]10^{-7}[/tex3]
d) 9 × [tex3]10^[-7}[/tex3]
e) 4 × [tex3]10^{-7}[/tex3]
Gabarito: Letra E
Já vi resoluções resolverem essa questão pela Lei de Ostwald. Mas minha dúvida é quanto ao meio normal de se resolver Ki=([tex3]\frac{[Produtos]}{[Reagentes]}[/tex3]
), sabe? Tentei resolver assim, buscando a primeira constante como a questão pediu, mas não bateu com o gabarito. Questões assim (para ácidos fracos) só são resolvidas pela Lei de Ostwald ou resolve-se pelo caminho que tentei também? Se sim, gostaria da resolução pelo segundo caminho, por favor. Abraços!
Olá, Comunidade!
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero )
)
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Físico-Química ⇒ (Ufsm 2004) Equilíbrio Iônico
Moderador: [ Moderadores TTB ]
-
danCMen1415

- Mensagens: 5
- Registrado em: 02 Dez 2016, 17:55
- Última visita: 15-12-16
- Agradeceu: 4 vezes
Dez 2016
02
18:30
(Ufsm 2004) Equilíbrio Iônico
Editado pela última vez por danCMen1415 em 02 Dez 2016, 18:30, em um total de 1 vez.
-
Helo

- Mensagens: 19
- Registrado em: 16 Jun 2015, 17:51
- Última visita: 11-08-17
- Agradeceu: 7 vezes
- Agradeceram: 10 vezes
Dez 2016
14
13:08
Re: (Ufsm 2004) Equilíbrio Iônico
Olá!
Neste caso usar a lei de Ostwald seria mais conveniente pelo fato do alfa (grau de ionização) ser menor que 5%, contudo bastaria fazer [tex3]K_{a}=M*\alpha ^2[/tex3] . Porém, há uma outra forma de resolver a questão, que é montando a tabelinha a seguir:
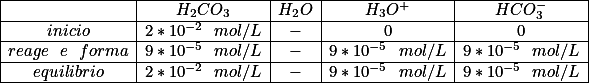
Na linha Reage e Forma reagiu-se apenas 0,45% da quantidade inicial da molaridade, e formou-se a mesma quantidade obedecendo a estequiometria da reação. Agora basta fazer:
[tex3]\\K_{a}=\frac{[H_{3}O^+]*[HCO_{3}^-]}{[H_{2}CO_{3}]} \\ \\K_{a}=\frac{(9*10^{-5})^2}{2*10^{-2}} \\ K_{a}=4,05*10^{-7}[/tex3]
Neste caso usar a lei de Ostwald seria mais conveniente pelo fato do alfa (grau de ionização) ser menor que 5%, contudo bastaria fazer [tex3]K_{a}=M*\alpha ^2[/tex3] . Porém, há uma outra forma de resolver a questão, que é montando a tabelinha a seguir:
Na linha Reage e Forma reagiu-se apenas 0,45% da quantidade inicial da molaridade, e formou-se a mesma quantidade obedecendo a estequiometria da reação. Agora basta fazer:
[tex3]\\K_{a}=\frac{[H_{3}O^+]*[HCO_{3}^-]}{[H_{2}CO_{3}]} \\ \\K_{a}=\frac{(9*10^{-5})^2}{2*10^{-2}} \\ K_{a}=4,05*10^{-7}[/tex3]
Editado pela última vez por Helo em 14 Dez 2016, 13:08, em um total de 1 vez.
-
danCMen1415

- Mensagens: 5
- Registrado em: 02 Dez 2016, 17:55
- Última visita: 15-12-16
- Agradeceu: 4 vezes
Dez 2016
14
21:17
Re: (Ufsm 2004) Equilíbrio Iônico
Ahh, sim. Entendi! Valeu!!!Helo escreveu:Olá!
Neste caso usar a lei de Ostwald seria mais conveniente pelo fato do alfa (grau de ionização) ser menor que 5%, contudo bastaria fazer [tex3]K_{a}=M*\alpha ^2[/tex3] . Porém, há uma outra forma de resolver a questão, que é montando a tabelinha a seguir:
Na linha Reage e Forma reagiu-se apenas 0,45% da quantidade inicial da molaridade, e formou-se a mesma quantidade obedecendo a estequiometria da reação. Agora basta fazer:
[tex3]\\K_{a}=\frac{[H_{3}O^+]*[HCO_{3}^-]}{[H_{2}CO_{3}]} \\ \\K_{a}=\frac{(9*10^{-5})^2}{2*10^{-2}} \\ K_{a}=4,05*10^{-7}[/tex3]
Editado pela última vez por danCMen1415 em 14 Dez 2016, 21:17, em um total de 1 vez.
-
skulllsux189

- Mensagens: 328
- Registrado em: 01 Fev 2018, 01:26
- Última visita: 13-08-19
- Agradeceu: 100 vezes
- Agradeceram: 12 vezes
-
analuizascrr

- Mensagens: 2
- Registrado em: 16 Mai 2018, 15:06
- Última visita: 18-08-19
Set 2018
19
16:15
Re: (Ufsm 2004) Equilíbrio Iônico
Alfa é o grau de ionização ou o grau de dissociação iônica.
[tex3]\alpha [/tex3] = nº de mols ionizados / nº de mols iniciais
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 1 Respostas
- 1292 Exibições
-
Última mensagem por Jigsaw
-
- 5 Respostas
- 9291 Exibições
-
Última mensagem por MatheusBorges
-
- 1 Respostas
- 1804 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 2 Respostas
- 1971 Exibições
-
Última mensagem por kevin22
-
- 1 Respostas
- 1766 Exibições
-
Última mensagem por VALDECIRTOZZI
