Soluções
Enviado: Seg 21 Nov, 2016 14:43
(Udesc) Para que efluentes industriais possam ser descartados sem prejudicar rios ou cursos d’água ou a fim de que a água potável possa ser distribuída à população, essas amostras passam por uma série de análises físico-químicas. Dois parâmetros muito importantes que devem ser controlados são conhecidos como Carbono Orgânico Total (COT) e Demanda Química de Oxigênio (DQO). A DQO representa a quantidade de oxigênio necessária à completa oxidação da matéria orgânica existente na amostra em dióxido de carbono. A DQO de um efluente pode ser determinada pela reação da matéria orgânica (simplificadamente representada como CH2O) com íons dicromato em meio ácido com aquecimento, segundo reação (1) abaixo:
Agora suponha que 1,00 L de um efluente industrial tenha requerido 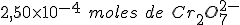 para reagir completamente com a matéria orgânica presente. A expressão correta da DQO dessa amostra, em mg de
para reagir completamente com a matéria orgânica presente. A expressão correta da DQO dessa amostra, em mg de 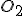 por litro de amostra, é:
por litro de amostra, é: