Olá, Comunidade!
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero )
)
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Físico-Química ⇒ Soluções Tópico resolvido
Moderador: [ Moderadores TTB ]
-
jessicabe

- Mensagens: 37
- Registrado em: 25 Mai 2016, 01:39
- Última visita: 23-05-19
- Agradeceu: 12 vezes
Nov 2016
21
14:43
Soluções
(Udesc) Para que efluentes industriais possam ser descartados sem prejudicar rios ou cursos d’água ou a fim de que a água potável possa ser distribuída à população, essas amostras passam por uma série de análises físico-químicas. Dois parâmetros muito importantes que devem ser controlados são conhecidos como Carbono Orgânico Total (COT) e Demanda Química de Oxigênio (DQO). A DQO representa a quantidade de oxigênio necessária à completa oxidação da matéria orgânica existente na amostra em dióxido de carbono. A DQO de um efluente pode ser determinada pela reação da matéria orgânica (simplificadamente representada como CH2O) com íons dicromato em meio ácido com aquecimento, segundo reação (1) abaixo:
Agora suponha que 1,00 L de um efluente industrial tenha requerido  para reagir completamente com a matéria orgânica presente. A expressão correta da DQO dessa amostra, em mg de
para reagir completamente com a matéria orgânica presente. A expressão correta da DQO dessa amostra, em mg de 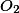 por litro de amostra, é:
por litro de amostra, é:
Editado pela última vez por jessicabe em 21 Nov 2016, 14:43, em um total de 3 vezes.
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2016
23
08:48
Re: Soluções
Pela estequiometria da reação 1, 3 mols de 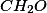 reagem com com 2 mols de
reagem com com 2 mols de 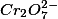 . Como foram consumidos
. Como foram consumidos 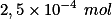 de íon
de íon 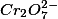 , havia, em solução,
, havia, em solução, 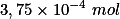 de
de 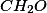 .
.
A reação entre o gás oxigênio e o composto orgânico é:
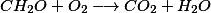
Logo, são consumidos para degradar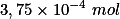 de
de 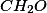 ,
, 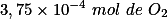 de
de 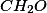 . Note que a estequiometria dessa reação é 1: 1.
. Note que a estequiometria dessa reação é 1: 1.
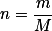
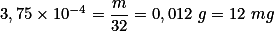
Espero ter ajudado!
A reação entre o gás oxigênio e o composto orgânico é:
Logo, são consumidos para degradar
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 23 Nov 2016, 08:48, em um total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 4 Respostas
- 6699 Exibições
-
Última mensagem por euqueroehmed
-
- 2 Respostas
- 2907 Exibições
-
Última mensagem por oziemilly
-
- 0 Respostas
- 622 Exibições
-
Última mensagem por oziemilly
-
- 1 Respostas
- 1478 Exibições
-
Última mensagem por VALDECIRTOZZI
-
- 1 Respostas
- 2019 Exibições
-
Última mensagem por MicheleAlves






