Resposta
Físico-Química ⇒ Solução tampão
Moderador: [ Moderadores TTB ]
Out 2016
29
12:45
Solução tampão
Uma solução tampão foi obtida pela mistura de 500,00 ml de HClO ) 0,500 mol/L com 500,00 ml de NaOH 0,400 mol/L. Calcule o volume necessário de HCl 1,00 mol/L ou NaOH 1,00 mol/L, para diminuir o pH do tampão em 0,4 unidades de pH.
0,500 mol/L com 500,00 ml de NaOH 0,400 mol/L. Calcule o volume necessário de HCl 1,00 mol/L ou NaOH 1,00 mol/L, para diminuir o pH do tampão em 0,4 unidades de pH.
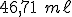
Última edição: julianab (Sáb 29 Out, 2016 12:45). Total de 2 vezes.
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Out 2016
31
08:21
Re: Solução tampão
Inicialmente temos a seguinte equação química que representa a reação de neutralização entre o ácido hipocloroso e o hidróxido de sódio:
%7D+NaOH_%7B(aq)%7D%5Clongrightarrow%20NaC%5Cell%20O_%7B(aq)%7D+H_2O_%7B(%5Cell)%7D)

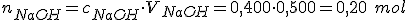
Pela estequiometria da reação, 1 mol de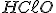 reage com 1 mol de NaOH; logo 0,2 mol de
reage com 1 mol de NaOH; logo 0,2 mol de 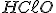 reage com 0,2 mol de NaOH. formando 0,2 mol de
reage com 0,2 mol de NaOH. formando 0,2 mol de 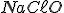 e restando, em solução,
e restando, em solução, 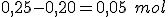 de
de 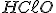 .
.
A solução tampão formada entre o ácido e seu sal obedece à seguinte equação química:
%7D%20%5Cleftrightharpoons%20H_%7B(aq)%7D%5E+%20+C%5Cell%20O_%7B(aq)%7D%5E-)
A equação de Henderson-Hasselbach nos dá o valor do pH do tampão e lembrando que o volume total, agora, é 1 litro:
![pH=pk_a + \log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]} pH=pk_a + \log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk_a%20+%20%5Clog%20%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D)

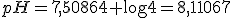
O valor do pH do tampão deve abaixar de 0,4 unidades, logo o novo valor do tampão será: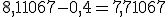
Então:
![pH=pk_a + \log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]} pH=pk_a + \log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=pk_a%20+%20%5Clog%20%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D)
![7,71067=-\log 3,1 \times 10^{-8}+\log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]} 7,71067=-\log 3,1 \times 10^{-8}+\log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?7,71067=-%5Clog%203,1%20%5Ctimes%2010%5E%7B-8%7D+%5Clog%20%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D)
![\log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=7,71067-7,50864=0,20203 \log \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=7,71067-7,50864=0,20203](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Clog%20%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D=7,71067-7,50864=0,20203)
![\frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=10^{0,20203}=1,59232 \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=10^{0,20203}=1,59232](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D=10%5E%7B0,20203%7D=1,59232)
Para abaixarmos o pH, devemos adicionar mais ácido clorídrico. Dessa forma, haverá consumo de íons hipoclorito e o equilíbrio se deslocará para a direita. Seja , o volume, em litros, de solução de
, o volume, em litros, de solução de 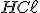 adicionado:
adicionado:
![\frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=\frac{\frac{0,20\cdot 1-1 \cdot v}{1+v}}{\frac{0,05 \cdot 1+1 \cdot v}{1+v}}=1,59232 \frac{\left[NaC\ell O_{(aq)}\right]}{\left[HC\ell O_{(aq)}\right]}=\frac{\frac{0,20\cdot 1-1 \cdot v}{1+v}}{\frac{0,05 \cdot 1+1 \cdot v}{1+v}}=1,59232](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cfrac%7B%5Cleft%5BNaC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D%7B%5Cleft%5BHC%5Cell%20O_%7B(aq)%7D%5Cright%5D%7D=%5Cfrac%7B%5Cfrac%7B0,20%5Ccdot%201-1%20%5Ccdot%20v%7D%7B1+v%7D%7D%7B%5Cfrac%7B0,05%20%5Ccdot%201+1%20%5Ccdot%20v%7D%7B1+v%7D%7D=1,59232)
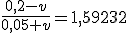
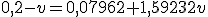
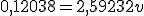
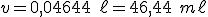
Espero ter ajudado!
Pela estequiometria da reação, 1 mol de
A solução tampão formada entre o ácido e seu sal obedece à seguinte equação química:
A equação de Henderson-Hasselbach nos dá o valor do pH do tampão e lembrando que o volume total, agora, é 1 litro:
O valor do pH do tampão deve abaixar de 0,4 unidades, logo o novo valor do tampão será:
Então:
Para abaixarmos o pH, devemos adicionar mais ácido clorídrico. Dessa forma, haverá consumo de íons hipoclorito e o equilíbrio se deslocará para a direita. Seja
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Seg 31 Out, 2016 08:21). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 0 Respostas
- 431 Exibições
-
Última msg por lipemachado
-
- 1 Respostas
- 786 Exibições
-
Última msg por Jigsaw
-
- 0 Respostas
- 572 Exibições
-
Última msg por fab12
-
- 0 Respostas
- 483 Exibições
-
Última msg por Veen
-
- 0 Respostas
- 443 Exibições
-
Última msg por victorjão








