(Desconhecimento da fonte). Uma solução tampão pH= 9,37 constituído de 0,24 mol/L de NH4OH e 0,18 mol/L de NH4Cl foi preparado de modo a obter 500 mL de solução. Dado o Kb = 1,8 . 10-5 Pede-se: a. Adiciona-se toda a solução de HCl 500 mL à 0,26 mol/L na solução tampão. Qual o valor do novo pH da solução tampão? Explique o ocorreu? R= pH= 2 .
Eu tentei resolver de três formas, mas nenhuma chegou a pH=2. Além disso, me parece que esse pH=2 é um tanto estranho, visto que a solução é tampão.
Físico-Química ⇒ Solução Tampão
Moderador: [ Moderadores TTB ]
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Out 2016
25
07:59
Re: Solução Tampão
Veja, o ácido clorpidrico adicionado irá reagir com a base segundo a equação química:
%7D+HC%5Cell_%7B(aq)%7D%20%5Clongrightarrow%20NH_4C%5Cell_%7B(aq)%7D+H_2O_%7B(%5Cell)%7D)
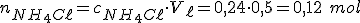
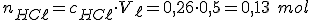
Como a estequiometria da reação acima é 1 : 1, temos que 0,12 mol de base reagem com 0,12 mol de ácido e sobram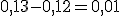 mol de ácido em solução.
mol de ácido em solução.
Logo temos (e lembrando que agora o volume final 1 litro}:
![pH=\log \left[H^+_{(aq)}\right]=-\log \frac{0,01}{1}=2 pH=\log \left[H^+_{(aq)}\right]=-\log \frac{0,01}{1}=2](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=%5Clog%20%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D=-%5Clog%20%5Cfrac%7B0,01%7D%7B1%7D=2)
Espero ter ajudado!
Como a estequiometria da reação acima é 1 : 1, temos que 0,12 mol de base reagem com 0,12 mol de ácido e sobram
Logo temos (e lembrando que agora o volume final 1 litro}:
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Ter 25 Out, 2016 07:59). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 0 Respostas
- 436 Exibições
-
Última msg por lipemachado
-
- 1 Respostas
- 797 Exibições
-
Última msg por Jigsaw
-
- 0 Respostas
- 579 Exibições
-
Última msg por fab12
-
- 0 Respostas
- 491 Exibições
-
Última msg por Veen
-
- 0 Respostas
- 461 Exibições
-
Última msg por victorjão








