(UFCE) Termoquímica
Enviado: Sáb 30 Jul, 2016 19:33
Olá pessoal estou com muito dificuldade de fazer esse exercício....
(UFCE) A reação de fotossíntese é%7D+6%20%5C%20H_2O_%7B(%5Cell)%7D%20%5Clongrightarrow%20C_6H_%7B12%7DO_6%7B(s)%7D%20+%206%20%5C%20O_2%7B(g)%7D) . Estima-se que, em uma floresta tropical, cerca de
. Estima-se que, em uma floresta tropical, cerca de 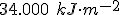 de energia solar são armazenados pelas plantas para realização da fotossíntese durante o período de um ano. A partir dos valores de entalpia-padrão de formação fornecidos a seguir, calcule:
de energia solar são armazenados pelas plantas para realização da fotossíntese durante o período de um ano. A partir dos valores de entalpia-padrão de formação fornecidos a seguir, calcule:
Substância----------Entalpia-padrão de formação (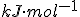 )
)
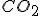 ----------------- -394
----------------- -394
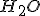 ----------------- -286
----------------- -286
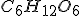 ---------- -1275
---------- -1275
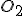 ------------------- 0
------------------- 0
A) A massa de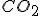 que será retirada da atmosfera por m² de floresta tropical durante o período de um ano?
que será retirada da atmosfera por m² de floresta tropical durante o período de um ano?
B) A massa de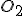 que será retirada da atmosfera por m² de floresta tropical durante o período de um ano?
que será retirada da atmosfera por m² de floresta tropical durante o período de um ano?
OBS: Eu calculei a entalpia de formação e deu: -2805 e também calculei a massa de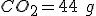 e também de
e também de 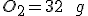 , Agora não sei como prosseguir.
, Agora não sei como prosseguir.
(UFCE) A reação de fotossíntese é
Substância----------Entalpia-padrão de formação (
A) A massa de
B) A massa de
OBS: Eu calculei a entalpia de formação e deu: -2805 e também calculei a massa de