Físico-Química ⇒ Termoquímica Tópico resolvido
Moderador: [ Moderadores TTB ]
Jun 2016
28
20:23
Termoquímica
Calcule a energia de aromatização do ciclo-hexano de acordo com a reação abaixo, considerando que o benzeno e o ciclo-hexano estão na fase líquida:
Dados: energia de ligação em kJ/mol: (C-C) = 348, (C-H) = 415, (C=C) = 600 e (H-H) = 436. Calor de sublimação do C(graf.) = +717 kJ/mol. Energia de ressonância do C6H6(líquido) = -152 kJ/mol. Calor de vaporização do C6H6(líquido) = +30,8 k/J. Calor de vaporização do C6H12(líquido) = +33 kJ/mol.
Última edição: marguiene (Ter 28 Jun, 2016 20:23). Total de 1 vez.
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Jul 2016
01
12:42
Re: Termoquímica
Abaixo, está um tentativa de solução do problema. O principal ponto encontra-se no cálculo do 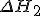 , ele deveria ser positivo e não negativo.
, ele deveria ser positivo e não negativo.
Talvez a chave para solução seja a entalpia de sublimação do carbono, mas sinceramente não sei onde ela entra. Espero que com isso você possa ter algo em mãos para procurar ajuda onde estuda. Note que que o 1,3,5 hexatrieno é um composto hipotético.
Inicialmente vaporiza-se o ciclohexano:
%7D%20%5Clongrightarrow%20C_6H_%7B12%7D_%7B(g)%7D%20%5C,%5C,%5C,%5C,%5C,%5C,%5C,%5C,%5C,%20%5CDelta%20H_1=+33%20%5C%20kJ)
O ciclo hexano é desidrogenado para ciclo 1,3,5 hexatrieno:
%7D%20%5Clongrightarrow%20C_6H_%7B6%7D_%7B(g)%7D%5C,%5C,%5C,%20(ciclohexatrieno)+3%20%5C%20H_2_%7B(g)%7D)
Para o cálculo da entalpia dessa reação (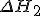 ), utilizamos as energias de ligação:
), utilizamos as energias de ligação:
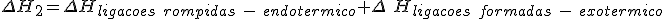
![\Delta H_2=\left[6 \cdot (C-C)+12 \cdot (C-H)\right]+\left[6 \cdot (C=C)+6 \cdot (C-H)+3 \cdot (H-H)\right] \Delta H_2=\left[6 \cdot (C-C)+12 \cdot (C-H)\right]+\left[6 \cdot (C=C)+6 \cdot (C-H)+3 \cdot (H-H)\right]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5CDelta%20%20H_2=%5Cleft%5B6%20%5Ccdot%20(C-C)+12%20%5Ccdot%20(C-H)%5Cright%5D+%5Cleft%5B6%20%5Ccdot%20(C=C)+6%20%5Ccdot%20(C-H)+3%20%20%5Ccdot%20(H-H)%5Cright%5D)
![\Delta H_2=\left(6 \cdot 348+12 \cdot 415\right)+\left[6 \cdot (-600)+6 \cdot (-415)+3 \cdot (-436)\right] \Delta H_2=\left(6 \cdot 348+12 \cdot 415\right)+\left[6 \cdot (-600)+6 \cdot (-415)+3 \cdot (-436)\right]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5CDelta%20H_2=%5Cleft(6%20%5Ccdot%20348+12%20%5Ccdot%20415%5Cright)+%5Cleft%5B6%20%5Ccdot%20(-600)+6%20%5Ccdot%20(-415)+3%20%5Ccdot%20(-436)%5Cright%5D)
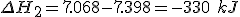
Liquefazendo o 1,3,5 ciclo hexatrieno:
A aromatização do clico 1,3,5 hexatrieno leva ao benzeno:
%7D%5C,%5C,%5C,%20(ciclohexatrieno)%20%5Clongrightarrow%20C_6H_%7B12%7D_%7B(%5Cell)%7D%5C,%5C,%5C,%20(ciclohexatrieno)%20%5C,%5C,%5C,%5C,%5C,%5C,%20%5CDelta%20H_3=-30,8%20%5C%20%20kJ)
Aromatizando o ciclo hexatrieno para benzeno:
%7D%5C,%5C,%5C,%20(ciclohexatrieno)%20%5Clongrightarrow%20C_6H_%7Bg%7D_%7B(%5Cell)%7D%5C,%5C,%5C,%20(benzeno)%20%5C,%5C,%5C,%5C,%5C,%5C,%20%5CDelta%20H_4=-152%20kJ)
Talvez a chave para solução seja a entalpia de sublimação do carbono, mas sinceramente não sei onde ela entra. Espero que com isso você possa ter algo em mãos para procurar ajuda onde estuda. Note que que o 1,3,5 hexatrieno é um composto hipotético.
Inicialmente vaporiza-se o ciclohexano:
O ciclo hexano é desidrogenado para ciclo 1,3,5 hexatrieno:
Para o cálculo da entalpia dessa reação (
Liquefazendo o 1,3,5 ciclo hexatrieno:
A aromatização do clico 1,3,5 hexatrieno leva ao benzeno:
Aromatizando o ciclo hexatrieno para benzeno:
Última edição: VALDECIRTOZZI (Sex 01 Jul, 2016 12:42). Total de 1 vez.
So many problems, so little time!
-
Tassandro

- Mensagens: 1905
- Registrado em: Sáb 15 Fev, 2020 17:01
- Última visita: 03-10-23
- Localização: Teresina, PI.
Jun 2020
18
09:00
Re: Termoquímica
marguiene,
VALDECIRTOZZI,
Não precisamos dessa entalpia de sublimação.
[tex3]C_6H_{{12}_{(g)}}\to C_6H_{6_{(g)}}+3H_{2_{(g)}}
~~~~ΔH_1\\
C_6H_{{12}_{(\ell)}}\to C_6H_{{12}_{(g)}}~~~~ΔH_2\\
C_6H_{6_{(g)}}\to C_6H_{6_{(\ell)}}~~~~ΔH_3\\
C_6H_{6_{(\ell)}}\to C_6H_{6_{(\ell)}}~~~~ΔH_4[/tex3]
Somando tudo, vamos achar
[tex3]C_6H_{12_{(\ell)}}\to C_6H_{6_{(\ell)}}+3H_{2_{(g)}}~~~ΔH[/tex3]
Temos que
[tex3]ΔH_1=6\cdot348+12\cdot415-(3\cdot348+6\cdot415+3\cdot690+3\cdot436)=426\text{ kJ}\\
ΔH_2=+33\text{kJ}\\
ΔH_3=-30,8\text{ kJ}\\
ΔH_4=-152\text{ kJ}\tag*{}[/tex3]
Assim, pela Lei de Hess
[tex3]ΔH=ΔH_1+ΔH_2+ΔH_3+ΔH_4=+276,2\text{ kJ}\tag*{}[/tex3]
VALDECIRTOZZI,
Não precisamos dessa entalpia de sublimação.
[tex3]C_6H_{{12}_{(g)}}\to C_6H_{6_{(g)}}+3H_{2_{(g)}}
~~~~ΔH_1\\
C_6H_{{12}_{(\ell)}}\to C_6H_{{12}_{(g)}}~~~~ΔH_2\\
C_6H_{6_{(g)}}\to C_6H_{6_{(\ell)}}~~~~ΔH_3\\
C_6H_{6_{(\ell)}}\to C_6H_{6_{(\ell)}}~~~~ΔH_4[/tex3]
Somando tudo, vamos achar
[tex3]C_6H_{12_{(\ell)}}\to C_6H_{6_{(\ell)}}+3H_{2_{(g)}}~~~ΔH[/tex3]
Temos que
[tex3]ΔH_1=6\cdot348+12\cdot415-(3\cdot348+6\cdot415+3\cdot690+3\cdot436)=426\text{ kJ}\\
ΔH_2=+33\text{kJ}\\
ΔH_3=-30,8\text{ kJ}\\
ΔH_4=-152\text{ kJ}\tag*{}[/tex3]
Assim, pela Lei de Hess
[tex3]ΔH=ΔH_1+ΔH_2+ΔH_3+ΔH_4=+276,2\text{ kJ}\tag*{}[/tex3]
Dias de luta, dias de glória.
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 0 Respostas
- 536 Exibições
-
Última msg por iammaribrg
-
- 0 Respostas
- 547 Exibições
-
Última msg por LadyGodiva
-
- 1 Respostas
- 1514 Exibições
-
Última msg por Ósmio
-
- 0 Respostas
- 449 Exibições
-
Última msg por iammaribrg
-
- 0 Respostas
- 371 Exibições
-
Última msg por SHolmes








