As bolsas térmicas de água quente ou de água fria são baseadas na dissolução de um sal em água, o que pode ser um processo endotérmico ou exotérmico. Um químico dissolveu 4,10 g de nitrato de potássio em água, a 25°C, totalizando 40 g de solução aquosa. Considere que não há perda de calor para as vizinhanças e a capacidade calorífica da solução aquosa é
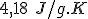
. A entalpia de dissolução do nitrato de potássio é
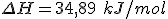
.
Massas molares em g/mol: K = 39, N = 14, O = 16.
Com base nos dados fornecidos, a temperatura final aproximada da solução será de:
a) 20,1°C
b) 16,5°C
c) 33,5°C
d) 29,9°C
e) 12,8°C

- Screenshot_14.jpg (21.9 KiB) Exibido 3259 vezes
Estou com dúvidas com relação à diminuição da temperatura da solução. Imaginei algo mais ou menos assim. Eu sei que a quebra de uma ligação é um processo endotérmico, então ao fornecermos energia ao
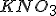
, esta energia quebrará as ligações existentes no nitrato de potássio com a consequente absorção da energia pelos elétrons das ligações. Então os elétrons não deixariam a energia fornecida dissipar-se para a solução. É por isso que a temperatura do sistema diminui?









