Também denominado anidrido sulfúrico , o trióxido de enxofre é um composto inorgânico , representado pela fórmula química
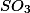
, é gasoso, incolor, irritante, reage violentamente com água, é instável e corrosivo.O trióxido de enxofre é obtido por meio da oxidação do dióxido de enxofre , tento o pentóxido de vanádio como catalizador da reação realizada pelo método de contato. Observe:
}+\frac{1}{2} O_2_{(g)} \longrightarrow SO_3{(g)})
Ressalta-se que as entalpias de formação ,em kJ/mol, do
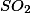
e
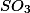
são, respectivamente -297 e -420.A entalpia de combustão de 12,8 gramas, em KJ, do dióxido de enxofre é igual a :
A)-123
B)+123
C)-24,6
D)+24,6


