Consideremos a reação de combustão do composto:

O que é importanto observar é que se formaram 1,100 g de
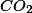
e todo o carbono veio do composto. Se em 44 g de
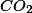
há 12 g de carbono em 1,100 g desse gás haverá 0,3 g.
Da mesma forma, todo o hidrogênio da água veio do composto, pelo mesmo raciocínio temos em em 18 g de água há 2 g de hidrogênio, então em 0,450 g de água haverá 0,05 g de hidrogênio.
A massa total até agora é 0,3 g de carbono e 0,05 g de hidrogênio. Como a massa incial do composto era 0,45 g, sobra 0,1 g para o oxigênio.
Então:

Dividindo pelas massa atômicas:


Dividindo pelo menor:

, que é a fórmula mínima e sua massa molar é 72 g\mol
Agora pela análise crióscópica, vemos que o abaixamento da temperatura de congelamento é 0,093° C. Note que 0,095 é superresfriamento.

})
, em que

é o número de mols do composto desconhecido e
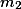
é a massa do solvente.



Essa massa molar é o dobro da fórmula mínima, portanto o composto é

.
Espero ter ajudado!


