Um recipiente armazenava, inicialmente, 275 mL de solução aquosa de ácido sulfúrico. Foi lentamente adicionada à solução citada, uma solução aquosa de hidróxido de sódio com pH igual a 12.
A tabela a seguir representa a variação do pH da solução ácida durante o período em que a solução básica foi adicionada. A temperatura das duas soluções permaneceu constante e igual a 25°C durante todo o experimento.
Volume adicionado de solução básica, em mL -> pH da solução ácida
0 -> 2
225 -> x
Considerando a completa dissociação dos eletrólitos, o valor numérico de x é
(A) 3. (B) 4.
(C) 5. (D) 6.
(E) 11.
Físico-Química ⇒ (UNIFESO 2014.2) Dissociação eletrolítica
Moderador: [ Moderadores TTB ]
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Nov 2014
27
09:18
Re: (UNIFESO 2014.2) Dissociação eletrolítica
A dissociação do ácido sulfúrico pode ser representada pela equação abaixo:
%7D%20%5Crightarrow%202H%5E+_%7B(aq)%7D+SO_4%5E%7B2-%7D_%7B(aq)%7D)
Pelos dados da tabela, o pH dessa solução é 2, ou seja,![\left[H^+_{(aq)}\right]=0,01 \ mol/\ell \left[H^+_{(aq)}\right]=0,01 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D=0,01%20%5C%20mol/%5Cell) .
.
Com a relação estequiométrica é 1 : 2 (ácido sulfúrico e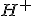 ), temos que a
), temos que a ![\left[H_2SO_4_{(aq)}\right]=0,005 \ mol/\ell \left[H_2SO_4_{(aq)}\right]=0,005 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_2SO_4_%7B(aq)%7D%5Cright%5D=0,005%20%5C%20mol/%5Cell) .
.
Como há 275 =0,275 L de solução ácida, o número de mols de ácido sulfúrico será:
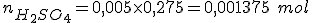
Com relação à base, o pH=12, ou seja,![\left[H^+_{(aq)}\right]=10^{-12} \ mol/\ell \left[H^+_{(aq)}\right]=10^{-12} \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D=10%5E%7B-12%7D%20%5C%20mol/%5Cell) , portanto
, portanto ![\left[OH^-_{(aq)}\right]=10^{-2}=0,01 \ mol/\ell \left[OH^-_{(aq)}\right]=10^{-2}=0,01 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BOH%5E-_%7B(aq)%7D%5Cright%5D=10%5E%7B-2%7D=0,01%20%5C%20mol/%5Cell) . Como a base tem apenas uma hidroxila, temos qu:e
. Como a base tem apenas uma hidroxila, temos qu:e ![\left[NaOH_{(aq)}\right]=0,01 \ mol/\ell \left[NaOH_{(aq)}\right]=0,01 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BNaOH_%7B(aq)%7D%5Cright%5D=0,01%20%5C%20mol/%5Cell) , daí:
, daí:
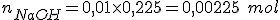
Durante a adição de base a reação que ocorre é descrita pela equação abaixo:
%7D+2NaOH_%7B(aq)%7D%20%5Crightarrow%20Na_2SO_4_%7B(aq)%7D+2H_2O_%7B(%5Cell)%7D)
A estequiometria é 1 mol de ácido é neutralizado por 2 mols de base, então:
0,00225 mol de NaOH neutralizará: de ácido.
de ácido.
Como há, em solução, 0,001375 mol de ácido, restará, após a adição da base, 0,001375-0,001125=0,00025 mol de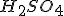 .
.
Pela equação de dissociação do ácido sulfúrico, teremos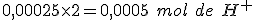 .
.
![\left[H^+_{(aq)}\right]=\frac{n_{H^+}}{V(\ell)} \left[H^+_{(aq)}\right]=\frac{n_{H^+}}{V(\ell)}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D=%5Cfrac%7Bn_%7BH%5E+%7D%7D%7BV(%5Cell)%7D) , o volume final é 500 mL.
, o volume final é 500 mL.
![\left[H^+_{(aq)}\right]=\frac{0,0005}{0,5}=0,001 \ mol/\ell \left[H^+_{(aq)}\right]=\frac{0,0005}{0,5}=0,001 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D=%5Cfrac%7B0,0005%7D%7B0,5%7D=0,001%20%5C%20mol/%5Cell)
Portanto o valor do pH será:
![pH=-\log \left[H^+_{(aq)}\right] pH=-\log \left[H^+_{(aq)}\right]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=-%5Clog%20%5Cleft%5BH%5E+_%7B(aq)%7D%5Cright%5D)
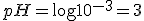
Espero ter ajudado!
Pelos dados da tabela, o pH dessa solução é 2, ou seja,
Com a relação estequiométrica é 1 : 2 (ácido sulfúrico e
Como há 275 =0,275 L de solução ácida, o número de mols de ácido sulfúrico será:
Com relação à base, o pH=12, ou seja,
Durante a adição de base a reação que ocorre é descrita pela equação abaixo:
A estequiometria é 1 mol de ácido é neutralizado por 2 mols de base, então:
0,00225 mol de NaOH neutralizará:
Como há, em solução, 0,001375 mol de ácido, restará, após a adição da base, 0,001375-0,001125=0,00025 mol de
Pela equação de dissociação do ácido sulfúrico, teremos
Portanto o valor do pH será:
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Qui 27 Nov, 2014 09:18). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 1 Respostas
- 302 Exibições
-
Última msg por medyorianna
-
- 1 Respostas
- 830 Exibições
-
Última msg por Tassandro
-
- 1 Respostas
- 635 Exibições
-
Última msg por Jigsaw
-
- 1 Respostas
- 476 Exibições
-
Última msg por Jigsaw
-
- 0 Respostas
- 263 Exibições
-
Última msg por Hudson535








