Olá!
Vamos pensar um pouco sobre eletrólises aquosas: Nesse tipo de eletrólise devemos considerar não só os íons provenientes do soluto, mas também os da água, provenientes de sua ionização.
Estou achando estranho porque algumas das equações dadas não serão utilizadas, então posso estar resolvendo por um método não adequado à questão... Ainda assim, é possível obter a resposta!
Sabe-se, porém, que apenas um cátion e um ânion sofrem descargas nos eletrodos...
Pela ordem de prioridade:
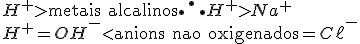
Assim, as reações catódicas e anódicas, respectivamente são:
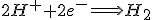
e

A reação global pode ser obtida a partir de todas as reações que ocorrem:
%7D+2H_2O_%7B(%5Cell)%7D%20%5CLongrightarrow%202Na%5E+_%7B(aq)%7D+OH%5E-_%7B(aq)%7D+H_2_%7B(g)%7D+C%5Cell_2_%7B(g)%7D)
Ou seja: Há a formação de ânions hidroxila e consumo de cátions hidrogênio, o que confere à solução um caráter básico (aumento de

). Os elementos Hidrogênio e cloro são liberados no estado gasoso em dois eletrodos diferentes, portanto não há deposição de sódio metálico. A reação anódica foi demonstrada acima... Para calcular o potencial padrão da equação global basta somar os potenciais de cada equação parcial, mas não estou conseguindo porque não consegui fazer a questão com as reações dadas... Mas a ideia é essa mesmo. Espero que alguém aí consiga resolver de outro jeito, pra que eu também entendar melhor!
Abraços...









