alguém me ajuda na questão 03, desse link: http://www.profpc.com.br/Exerc%C3%ADcio ... o%2032.pdf
Vlw. =)
Físico-Química ⇒ Termoqúimica: Tópico resolvido
Moderador: [ Moderadores TTB ]
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Mai 2013
14
15:09
Re: Termoqúimica:
Consideremos o diagrama:
(Dados: massa molar 11Na = 23 g; 17Cℓ = 35,5 g )
É correto afirmar:
(01) No diagrama estão representados os processos de quebra ou formação de pelo menos três tipos de ligações químicas: covalente, iônica e metálica.
(02) ΔH6 = ΔH1 + ΔH2 + ΔH3 + ΔH4 + ΔH5
(03) A energia necessária para formar 1 mol de íons cloreto e 1 mol de íons sódio, ambos no estado gasoso, a partir de 1 mol de cloreto de sódio sólido, é igual a + 183,8 kcal.
(04) A variação da entalpia da reação%7D%20%5Crightarrow%20Na_%7B(s)%7D%20+%20%5Cfrac%7B1%7D%7B2%7D%20C%5Cell_2(g)) é igual a -98,2 kcal
é igual a -98,2 kcal
(05) A formação de 1 mol de íons sódio e 1 mol de íons cloreto, ambos no estado gasoso, a partir de sódio metálico e gás cloro, é um processo exotérmico.
Inicialmente, observe que o valor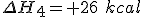 é, na realidade
é, na realidade 
Também note os seguinte:
 é a entalpia de formação do
é a entalpia de formação do 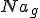 , endotérmica.
, endotérmica.
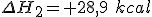 é a entalpia de formação do
é a entalpia de formação do 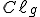 , endotérmica.
, endotérmica.
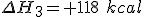 é a entalpia de ionização do
é a entalpia de ionização do 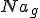 , endotérmica.
, endotérmica.
 é a entalpia de afinidade eletrônica do
é a entalpia de afinidade eletrônica do 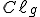 , exotérmica.
, exotérmica.
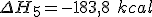 é a entalpia de formação da rede cristalina do
é a entalpia de formação da rede cristalina do 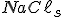 , exotérmica.
, exotérmica.
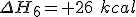 é a entalpia de formação do
é a entalpia de formação do 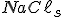 , exotérmica.
, exotérmica.
(1) Há quebra de ligação métalica quando se vaporiza sódio o sódio na estapa 1. Também há quebra de ligação covalente quando a molécula de na etapa 2.
na etapa 2.
Não há quebra de ligação iônica, e sim, sua formação na etapa 5.
(2) É verdade, pois a entalpia de formação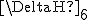 é definida como a energia mecessária para formar um compostos a partir de suas substância simples e nas condições padrão. Isso se obtem também varrendo o ciclo acima e o entalpia de formação será a soma das várias enrtalpias.
é definida como a energia mecessária para formar um compostos a partir de suas substância simples e nas condições padrão. Isso se obtem também varrendo o ciclo acima e o entalpia de formação será a soma das várias enrtalpias.
(3)Está correta, o enunciado se refere a e o seu valor é +183,8 kcal.
e o seu valor é +183,8 kcal.
(4) Este valor é o e se fizermos o cálculo conforme o item 2 , obteremos o valor de -98,2 kcal.
e se fizermos o cálculo conforme o item 2 , obteremos o valor de -98,2 kcal.
(5) As energias envolvidas são, respectivamente,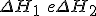 e são processos endotérmnicos, pois há necessidade de se fornecer energia para haver ruptura das ligaçãoes químicas.
e são processos endotérmnicos, pois há necessidade de se fornecer energia para haver ruptura das ligaçãoes químicas.
Espero ter ajudado!
(Dados: massa molar 11Na = 23 g; 17Cℓ = 35,5 g )
É correto afirmar:
(01) No diagrama estão representados os processos de quebra ou formação de pelo menos três tipos de ligações químicas: covalente, iônica e metálica.
(02) ΔH6 = ΔH1 + ΔH2 + ΔH3 + ΔH4 + ΔH5
(03) A energia necessária para formar 1 mol de íons cloreto e 1 mol de íons sódio, ambos no estado gasoso, a partir de 1 mol de cloreto de sódio sólido, é igual a + 183,8 kcal.
(04) A variação da entalpia da reação
(05) A formação de 1 mol de íons sódio e 1 mol de íons cloreto, ambos no estado gasoso, a partir de sódio metálico e gás cloro, é um processo exotérmico.
Inicialmente, observe que o valor
Também note os seguinte:
(1) Há quebra de ligação métalica quando se vaporiza sódio o sódio na estapa 1. Também há quebra de ligação covalente quando a molécula de
Não há quebra de ligação iônica, e sim, sua formação na etapa 5.
(2) É verdade, pois a entalpia de formação
(3)Está correta, o enunciado se refere a
(4) Este valor é o
(5) As energias envolvidas são, respectivamente,
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Ter 14 Mai, 2013 15:09). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 0 Respostas
- 537 Exibições
-
Última msg por iammaribrg
-
- 0 Respostas
- 548 Exibições
-
Última msg por LadyGodiva
-
- 1 Respostas
- 1515 Exibições
-
Última msg por Ósmio
-
- 0 Respostas
- 450 Exibições
-
Última msg por iammaribrg
-
- 0 Respostas
- 373 Exibições
-
Última msg por SHolmes








