Físico-Química ⇒ PH Tópico resolvido
Moderador: [ Moderadores TTB ]
-
Cloridríco

- Mensagens: 101
- Registrado em: Dom 22 Set, 2013 21:16
- Última visita: 23-09-23
Mai 2015
22
03:00
PH
Determine o pH das seguintes soluções: a)NH4OH 0,015Mol/l. b)CH3COOH 0,025Mol/l. c)solução cujos íons H3O+ apresentam 0,00000004Mol/l.
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Mai 2015
22
07:44
Re: PH
Você precisa fornecer as constantes de ionização da base e do ácido.
So many problems, so little time!
-
Cloridríco

- Mensagens: 101
- Registrado em: Dom 22 Set, 2013 21:16
- Última visita: 23-09-23
Mai 2015
22
09:04
Re: PH
Pois é Valdecir.Nesse exercício não foi dado as Ka e Kb.Eu te pergunto se é possível calcular assim mesmo,jphando ns formula de [H+] e [OH+],pondo em log ?
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Mai 2015
22
11:06
Re: PH
Sem as constantes, só podemos calcular o pH se tivermos ácidos e bases fortes.
Agora, ao responder-lhe, que notei o item c.
Estou entendendo nele, que temos uma solução muito diluída de ácido e não há íons hidroxila de base; por isso o pH da solução se aproxima do pH da água pura e não podemos aplicar as fórmulas tradicionais de cálculo de pH. Em outras palavras não temos, na verdade, uma solução alcalina.
Então:
![\left[H_3O^+ ]\right_{total} = \left[H_3O^+]\right_{acido} + \left[H_3O^+]\right_{H_2O} \left[H_3O^+ ]\right_{total} = \left[H_3O^+]\right_{acido} + \left[H_3O^+]\right_{H_2O}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_3O%5E+%20%5D%5Cright_%7Btotal%7D%20=%20%5Cleft%5BH_3O%5E+%5D%5Cright_%7Bacido%7D%20+%20%5Cleft%5BH_3O%5E+%5D%5Cright_%7BH_2O%7D)
![\left[OH^-\right]=\left[H_3O^+]\right_{H_2O}=x \left[OH^-\right]=\left[H_3O^+]\right_{H_2O}=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BOH%5E-%5Cright%5D=%5Cleft%5BH_3O%5E+%5D%5Cright_%7BH_2O%7D=x)
![k_w=\left[H_3O^+ ]_{total} \cdot \left[OH^-\right] k_w=\left[H_3O^+ ]_{total} \cdot \left[OH^-\right]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?k_w=%5Cleft%5BH_3O%5E+%20%5D_%7Btotal%7D%20%5Ccdot%20%5Cleft%5BOH%5E-%5Cright%5D)
![k_w=\left([H_3O^+]_{acido} + \left[H_3O^+\right]_{H_2O}\right) \cdot \left[OH^-\right] k_w=\left([H_3O^+]_{acido} + \left[H_3O^+\right]_{H_2O}\right) \cdot \left[OH^-\right]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?k_w=%5Cleft(%5BH_3O%5E+%5D_%7Bacido%7D%20+%20%5Cleft%5BH_3O%5E+%5Cright%5D_%7BH_2O%7D%5Cright)%20%5Ccdot%20%5Cleft%5BOH%5E-%5Cright%5D)
![k_w=\left( [H_3O^+]_{acido}+x \right) \cdot x k_w=\left( [H_3O^+]_{acido}+x \right) \cdot x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?k_w=%5Cleft(%20%5BH_3O%5E+%5D_%7Bacido%7D+x%20%5Cright)%20%5Ccdot%20x)
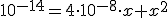
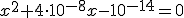
Resolvendo a equação de 2º grau e se não errei nos cálculos temos que:
![x=\left[OH^-\right]=8,198 \times 10^{-8} \ mol/\ell x=\left[OH^-\right]=8,198 \times 10^{-8} \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?x=%5Cleft%5BOH%5E-%5Cright%5D=8,198%20%5Ctimes%2010%5E%7B-8%7D%20%5C%20mol/%5Cell) , o que faz sentido, pois não há base no meio aquoso.
, o que faz sentido, pois não há base no meio aquoso.
![\left[H_3O^+ ]\right_{total} = \left[[H_3O^+]\right_{acido} + \left[H_3O^+]\right_{H_2O} \left[H_3O^+ ]\right_{total} = \left[[H_3O^+]\right_{acido} + \left[H_3O^+]\right_{H_2O}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_3O%5E+%20%5D%5Cright_%7Btotal%7D%20=%20%5Cleft%5B%5BH_3O%5E+%5D%5Cright_%7Bacido%7D%20+%20%5Cleft%5BH_3O%5E+%5D%5Cright_%7BH_2O%7D)
![\left[H_3O^+ ]\right_{total}=4 \cdot 10^{-8}+x \left[H_3O^+ ]\right_{total}=4 \cdot 10^{-8}+x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_3O%5E+%20%5D%5Cright_%7Btotal%7D=4%20%5Ccdot%2010%5E%7B-8%7D+x)
![\left[H_3O^+ ]\right_{total}=4 \cdot 10^{-8}+8,198 \cdot 10^{-8}=12,198 \cdot 10^{-8} \left[H_3O^+ ]\right_{total}=4 \cdot 10^{-8}+8,198 \cdot 10^{-8}=12,198 \cdot 10^{-8}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5Cleft%5BH_3O%5E+%20%5D%5Cright_%7Btotal%7D=4%20%5Ccdot%2010%5E%7B-8%7D+8,198%20%5Ccdot%2010%5E%7B-8%7D=12,198%20%5Ccdot%2010%5E%7B-8%7D)
![pH=-\log \left[H_3O^+ ]\right_{total}=-\log 12,198 \cdot 10^{-8}=6,91 pH=-\log \left[H_3O^+ ]\right_{total}=-\log 12,198 \cdot 10^{-8}=6,91](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=-%5Clog%20%5Cleft%5BH_3O%5E+%20%5D%5Cright_%7Btotal%7D=-%5Clog%2012,198%20%5Ccdot%2010%5E%7B-8%7D=6,91)
Espero ter ajudado!
Agora, ao responder-lhe, que notei o item c.
Estou entendendo nele, que temos uma solução muito diluída de ácido e não há íons hidroxila de base; por isso o pH da solução se aproxima do pH da água pura e não podemos aplicar as fórmulas tradicionais de cálculo de pH. Em outras palavras não temos, na verdade, uma solução alcalina.
Então:
Resolvendo a equação de 2º grau e se não errei nos cálculos temos que:
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Sex 22 Mai, 2015 11:06). Total de 1 vez.
So many problems, so little time!







