Olá, Comunidade!
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero )
)
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Vocês devem ter notado que o site ficou um período fora do ar (do dia 26 até o dia 30 de maio de 2024).
Consegui recuperar tudo, e ainda fiz um UPGRADE no servidor! Agora estamos em um servidor dedicado no BRASIL!
Isso vai fazer com que o acesso fique mais rápido (espero
Já arrumei os principais bugs que aparecem em uma atualização!
Mas, se você encontrar alguma coisa diferente, que não funciona direito, me envie uma MP avisando que eu arranjo um tempo pra arrumar!
Vamos crescer essa comunidade juntos
Grande abraço a todos,
Prof. Caju
Físico-Química ⇒ Mistura de soluções Tópico resolvido
Moderador: [ Moderadores TTB ]
-
Cloridríco

- Mensagens: 101
- Registrado em: 22 Set 2013, 21:16
- Última visita: 23-09-23
- Agradeceu: 20 vezes
Nov 2013
27
22:23
Mistura de soluções
(Pucsp).Adicionou-se 100mL de solução de Hg(NO3)2 de concentração 0,40mol\l a 100mL de solução de Na2S de concentração 0,20mol\l. sabendo-se que a reação ocorre com formação de um sal totalmente solúvel (NaNO3) e um sal praticamente insolúvel (HgS),as concentrações,em mol\l,dos íons Na e Hg 2+ presentes na solução final,são respectivamente ?
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: 04 Ago 2008, 17:08
- Última visita: 13-10-20
- Agradeceu: 197 vezes
- Agradeceram: 1590 vezes
Nov 2013
28
09:07
Re: Mistura de soluções
Façamos inicialmente a equação química correspondente à reação dada:
_2_{(aq)}+Na_2S_{(aq)} \rightarrow HgS_{(s)}+2NaNO_3_{(aq)})
Sabemos que o número de mols) pode ser dado pelo produto concnetração molar
pode ser dado pelo produto concnetração molar ) pelo volume em litros
pelo volume em litros ) da solução. Então:
da solução. Então:
_2}=0,4 \times 0,1=0,04 \ mol)
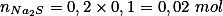
Então, há 0,04 mol do_2) e 0,02 mol do
e 0,02 mol do 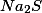 .
.
Pelos coeficientes estequiométricos da reação, 1 mol de_2) reage com 1 mol de
reage com 1 mol de 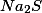 . Como o
. Como o 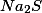 é o reagente limitante, 0,02 mol de
é o reagente limitante, 0,02 mol de 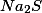 reage com 0,02 mol de
reage com 0,02 mol de _2) .
.
Portanto sobram em solução 0,02 mol de_2) e 1 mol deste sal gera 1 mol de íons
e 1 mol deste sal gera 1 mol de íons 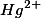 , daí a concentração molar desse íon será:
, daí a concentração molar desse íon será:
}=\frac{0,02}{0,4}=0,05 \ mol/\ell)
Os íons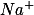 permanecem em solução. Temos que 1 mol de
permanecem em solução. Temos que 1 mol de 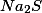 geral 2 mols de íon sódio, ou seja 0,02 do sal gera 0,04 mol de íons sódio.
geral 2 mols de íon sódio, ou seja 0,02 do sal gera 0,04 mol de íons sódio.
}=\frac{0,04}{0,4}=0,1 \ mol/\ell)
Espero ter ajudado!
Sabemos que o número de mols
Então, há 0,04 mol do
Pelos coeficientes estequiométricos da reação, 1 mol de
Portanto sobram em solução 0,02 mol de
Os íons
Espero ter ajudado!
Editado pela última vez por VALDECIRTOZZI em 28 Nov 2013, 09:07, em um total de 1 vez.
So many problems, so little time!
Crie uma conta ou entre para participar dessa discussão
Você precisa ser um membro para postar uma resposta
Crie uma nova conta
Ainda não é um membro? Registre-se agora!
Membro pode iniciar seus próprios tópicos e inscrever-se no dos outros para ser notificado sobre atualizações.
É gratuito e leva apenas 1 minuto
Entrar
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última mensagem
-
- 2 Respostas
- 11576 Exibições
-
Última mensagem por Nathaly
-
- 2 Respostas
- 1456 Exibições
-
Última mensagem por dudasaraiva
-
- 1 Respostas
- 1163 Exibições
-
Última mensagem por Jigsaw
-
- 0 Respostas
- 922 Exibições
-
Última mensagem por LZS
-
- 1 Respostas
- 80 Exibições
-
Última mensagem por Jigsaw







