A hidrólise de um sal pode fazer com que o pH de uma solução aquosa seja diferente do pH da água pura. Os valores de pH dependem do Ka e do Kb do acido e da base de origem. Considere a hidrólise do cianeto de amônio em uma solução de contração 0,2 mol/L. Qual seria o pH aproximado da solução ? (Ka do HCN: 4x10^-10 e Kb do NH3: 2x10^-5, temperatura em que se encontra a solução).
a) 7
b) 7,7
c) 9,35
d) 10,7
e) 12,2
Resposta: c
Físico-Química ⇒ (EMESCAM) Hidrólise/pH
Moderador: [ Moderadores TTB ]
Ago 2016
20
17:49
Re: (EMESCAM) Hidrólise/pH
Olá!
Como ele não fala em que temperatura essa reação se encontra, nós consideramos que seja a temperatura ambiente (25°C)
Esse sal é proveniente de uma base e ácido fracos. Com isso a hidrólise será:
%20%7D%5E%7B%20+%20%7D%5Cquad%20+%5Cquad%20CN_%7B%20(aq)%20%7D%5E%7B%20-%20%7D%5Cquad%20%5Crightleftharpoons%20%5Cquad%20NH_%7B%203(aq)%20%7D%5Cquad%20+%5Cquad%20HCN_%7B%20(aq)%20%7D%5C%5C%20%5C%5C)
Montando a tabelinha:
~~mol/L%20&%20(0,2-x)~~mol/L%20&%20x~~mol/L%20&%20x~~mol/L%20%5C%5C%20%5Chline%20%5Cend%7Barray%7D)
Podemos considerar a molaridade dos íons amônio e cianeto no equilíbrio como sendo aproximadamente 0,2 mol/L, em questões de hidrólises o alfa é muito pequeno (<5%), com isso a simplificação.
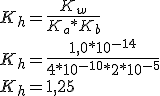
![K_{ h }=\frac { [HCN]*[NH_{ 3 }] }{ [NH_{ 4 }^{ + }]*[CN^{ - }] } \\ \\ 1,25=\frac { x*x }{ 0,2*0,2 } \\ \\ x^{ 2 }=5*10^{ -2 }\\ x=2,24*10^{ -1 } K_{ h }=\frac { [HCN]*[NH_{ 3 }] }{ [NH_{ 4 }^{ + }]*[CN^{ - }] } \\ \\ 1,25=\frac { x*x }{ 0,2*0,2 } \\ \\ x^{ 2 }=5*10^{ -2 }\\ x=2,24*10^{ -1 }](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?K_%7B%20h%20%7D=%5Cfrac%20%7B%20%5BHCN%5D*%5BNH_%7B%203%20%7D%5D%20%7D%7B%20%5BNH_%7B%204%20%7D%5E%7B%20+%20%7D%5D*%5BCN%5E%7B%20-%20%7D%5D%20%7D%20%5C%5C%20%5C%5C%201,25=%5Cfrac%20%7B%20x*x%20%7D%7B%200,2*0,2%20%7D%20%5C%5C%20%5C%5C%20x%5E%7B%202%20%7D=5*10%5E%7B%20-2%20%7D%5C%5C%20x=2,24*10%5E%7B%20-1%20%7D)
Agora fazemos a reação do ácido Cianídrico:
%20%7D%5Cquad%20+%5Cquad%20H_%7B%202%20%7DO_%7B%20(aq)%20%7D%5Cquad%20%5Crightleftharpoons%20%5Cquad%20CN%5E%7B%20-%20%7D_%7B%20(aq)%20%7D%5Cquad%20+%5Cquad%20H_%7B%203%20%7DO%5E%7B%20+%20%7D_%7B%20(aq)%20%7D)
Como temos os valores das molaridades e da constante de ionização, acharemos o valor do íon hidrônio e o pH:
[tex3]K_{ a }=\frac { [H_{ 3 }O^{ + }]*[CN^{ - }] }{ [HCN] } \\ \\ [H_{ 3 }O^{ + }]=K_{ a }*\frac { [HCN] }{ [CN^{ - }] } \\ \\ [H_{ 3 }O^{ + }]=4*10^{ -10 }*\frac { 2,24*10^{ -1 } }{ 2*10^{ -1 } } \\ \\ [H_{ 3 }O^{ + }]=4,48*10^{ -10 }\\ \\ \\ pH=10-log4,48\\ \boxed {pH=9,35}[/tex3]
Ou você simplesmente poderia fazer:
![[H^{ + }]=\sqrt { \frac { K_{ a }*K_{ w } }{ K_{ b } } } [H^{ + }]=\sqrt { \frac { K_{ a }*K_{ w } }{ K_{ b } } }](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BH%5E%7B%20+%20%7D%5D=%5Csqrt%20%7B%20%5Cfrac%20%7B%20K_%7B%20a%20%7D*K_%7B%20w%20%7D%20%7D%7B%20K_%7B%20b%20%7D%20%7D%20%20%7D)
Você encontraria o valor de ''H+'' e o pH respectivamente.
Como ele não fala em que temperatura essa reação se encontra, nós consideramos que seja a temperatura ambiente (25°C)
Esse sal é proveniente de uma base e ácido fracos. Com isso a hidrólise será:
Montando a tabelinha:
Podemos considerar a molaridade dos íons amônio e cianeto no equilíbrio como sendo aproximadamente 0,2 mol/L, em questões de hidrólises o alfa é muito pequeno (<5%), com isso a simplificação.
Agora fazemos a reação do ácido Cianídrico:
Como temos os valores das molaridades e da constante de ionização, acharemos o valor do íon hidrônio e o pH:
[tex3]K_{ a }=\frac { [H_{ 3 }O^{ + }]*[CN^{ - }] }{ [HCN] } \\ \\ [H_{ 3 }O^{ + }]=K_{ a }*\frac { [HCN] }{ [CN^{ - }] } \\ \\ [H_{ 3 }O^{ + }]=4*10^{ -10 }*\frac { 2,24*10^{ -1 } }{ 2*10^{ -1 } } \\ \\ [H_{ 3 }O^{ + }]=4,48*10^{ -10 }\\ \\ \\ pH=10-log4,48\\ \boxed {pH=9,35}[/tex3]
Ou você simplesmente poderia fazer:
Você encontraria o valor de ''H+'' e o pH respectivamente.
Última edição: Helo (Sáb 20 Ago, 2016 17:49). Total de 1 vez.
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg









