a)O
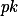
apenas é uma forma de nos dizer o valor da constante de equilíbrio:
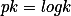
. O valor do ´H inicila depende da concentração inical do ácido, enquanto que o
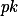
, apenas nos diz para que lado o equilíbrio está deslocado. No
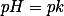
teremos concentrações iguais do ácido e do sal correspondente.
b) Como disse, acima a constante de ionização ou
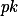
apenas nos diz para que lado o equilíbrio está deslocado. Ao adicionarmos uma base, o equilíbrio se desloca para a direita, neutralizando os
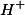
, seguindo sempre a proporção estequiométrica. No caso, como
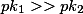
, consigo neutralizar o primeiro
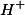
antes que o segundo comece a ser neutralizado, consigo, portanto, uma neutralização quantitativa e duas inflexões, como mostradas nos gráficos. A princípio, conseguiria, também, a terceira inflexão já que
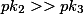
, mas
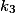
é muito pequena, daí não teria, na prática, uma visualização dessa terceira inflexão, ou seria muito difícil determiná-la.
Espero ter ajudado!


