Das soluções apresentadas, note que a solução de
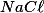
possui cátion e ânion provenientes de bases e ácidos fortes e sua solução é neutra. A solução de ácido acético
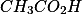
é um ácido e seu
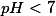
. Com relação ao álcool etílico
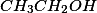
, sua fraca ionização é totalmente inibida pela água.
O íon nitrito
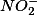
hidrolisa e sua constante de hidrólise
)
é dada por:
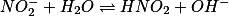
![k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]} k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]})
)
![k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]}\cdot \frac{[H^+]}{[H^+]} k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]}\cdot \frac{[H^+]}{[H^+]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]}\cdot \frac{[H^+]}{[H^+]})
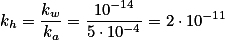
O íon amônio
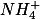
hidrolisa e sua constante de hidrólise
)
é dada por:
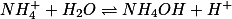
![k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]} k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?k_h=\frac{[HNO_2][OH^-]}{[NO_2^-]})
)
![k_h=\frac{[NH_4OH][H^+]}{[NH_4^+]}\cdot \frac{[OH^-]}{[OH^-]} k_h=\frac{[NH_4OH][H^+]}{[NH_4^+]}\cdot \frac{[OH^-]}{[OH^-]}](https://www.tutorbrasil.com.br/latex/mathtex.cgi?k_h=\frac{[NH_4OH][H^+]}{[NH_4^+]}\cdot \frac{[OH^-]}{[OH^-]})
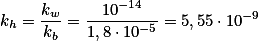
Sem precisarmos realizar cálculos, veja que a solução de nitrito de potássio em meio aquoso, ao sofrer hidrólise libera íons
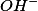
o que faz com que o
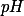
de sua solução aquosa ser maior que
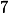
.
Espero ter ajudado!

