O gás cianídrico (HCN) é largamente utilizado pela indústria de polímeros e corantes. Essa substância também é empregada na mineração dos metais prata e ouro. O ácido nitroso (HNO2), apesar de instável, tem aplicação na produção de corantes
para a indústria têxtil.Sabe-se que uma solução aquosa de HNO2 de concentração 0,01 mol/L apresenta pH = 2,7. Então,
uma solução de mesma concentração de HCN apresentará
(A) pH = 3,3.
(B) pH = 5,3.
(C) pH = 1,7.
(D) pH = 5,7.
(E) pH = 8,7
ALTERNATIVA CORRETA D alguém sabe resolver ?
Físico-Química ⇒ Calculo de pH
Moderador: [ Moderadores TTB ]
-
VALDECIRTOZZI

- Mensagens: 2569
- Registrado em: Seg 04 Ago, 2008 17:08
- Última visita: 13-10-20
Jul 2014
29
08:53
Re: Calculo de pH
A equação química que representa o equilíbrio do 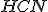 com seus íons é:
com seus íons é:
%7D%20%5Crightleftharpoons%20H%5E+_%7B(aq)%7D+CN%5E-_%7B(aq)%7D)
Inicialmente temos:
![[HCN]=0,01 \ mol/\ell [HCN]=0,01 \ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BHCN%5D=0,01%20%5C%20mol/%5Cell)
![[H^+]=0 [H^+]=0](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BH%5E+%5D=0)
![[CN^-]=0 [CN^-]=0](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BCN%5E-%5D=0)
Reagem:
![[HCN]=x [HCN]=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BHCN%5D=x)
![[H^+]=x [H^+]=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BH%5E+%5D=x)
![[CN^-]=x [CN^-]=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BCN%5E-%5D=x)
No equilíbrio restam/formam:
![[HCN]=0,01 -x\ mol/\ell [HCN]=0,01 -x\ mol/\ell](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BHCN%5D=0,01%20-x%5C%20mol/%5Cell)
![[H^+]=x [H^+]=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BH%5E+%5D=x)
![[CN^-]=x [CN^-]=x](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?%5BCN%5E-%5D=x)
Como , temos que
, temos que 
A expressão da constante de equilíbrio:
![k_a=\frac{[H^+_{(aq)}]\cdot [CN^-_{(aq)}]}{[HCN_{(aq)}]} k_a=\frac{[H^+_{(aq)}]\cdot [CN^-_{(aq)}]}{[HCN_{(aq)}]}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?k_a=%5Cfrac%7B%5BH%5E+_%7B(aq)%7D%5D%5Ccdot%20%5BCN%5E-_%7B(aq)%7D%5D%7D%7B%5BHCN_%7B(aq)%7D%5D%7D)
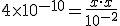
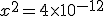
![x=[H^+]=2 \times 10^{-6} x=[H^+]=2 \times 10^{-6}](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?x=%5BH%5E+%5D=2%20%5Ctimes%2010%5E%7B-6%7D)
![pH=-\log [H^+] pH=-\log [H^+]](https://www.tutorbrasil.com.br/latex/mimetex_.cgi?pH=-%5Clog%20%5BH%5E+%5D)
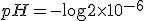
)
)
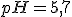
Espero ter ajudado!
Inicialmente temos:
Reagem:
No equilíbrio restam/formam:
Como
A expressão da constante de equilíbrio:
Espero ter ajudado!
Última edição: VALDECIRTOZZI (Ter 29 Jul, 2014 08:53). Total de 1 vez.
So many problems, so little time!
-
- Tópicos Semelhantes
- Respostas
- Exibições
- Última msg
-
- 3 Respostas
- 9987 Exibições
-
Última msg por Cardoso1979
-
- 1 Respostas
- 6563 Exibições
-
Última msg por Cardoso1979
-
- 1 Respostas
- 3594 Exibições
-
Última msg por AnthonyC
-
- 9 Respostas
- 5449 Exibições
-
Última msg por geobson








